
I. PHẦN TRẮC NGHIỆM
1. Dung dịch KOH 0,001M cần pha loãng bằng nước bao nhiều lầm để được dung dịch có pH=9?
A.80 lần B.90 lần
C.100 lần D.110 lần
2. Biết độ điện li của dung dịch axit CH3COOH 1,2M là 1,5%. Nồng độ mol/l của ion CH3COO– trong dung dịch trên là:
A. 0,018M B. 0,015M
C. 0,012 M D. 0,014M.
3. Sau khi trộn 100ml dung dịch HCl 1M với 400ml dung dịch NaOH 0,375M thì pH dung dịch sau khi pha trộn là:
A.11,0 B.11,5
C.13,0 D.14,0
4. Cho 1,92 gam Cu tác dụng vừa hết với V lít dung dịch HNO3 0,1M loãng. Giá trị của V là:
A. 0,80 lít B. 0,85 lít
C. 0,90 lít. D. 0,95 lít.
5. Ngâm một vật bằng đồng có khối lượng 10 gam vào 250 gam dung dịch AgNO3 4%. Khi lấy vật ra thì lượng AgNO3 trong dung dịch giảm 17%. Khối lượng của vật sau phản ứng là:
A. 10,50 gam B. 11,25 gam
C. 10,76 gam D. 9,50 gam.
6. Cho 12,8 gam đồng tác dụng hết với dung dịch HNO3 thu được hỗn hợp khí gồm NO và NO2,
có tỉ khối hơi đối với H là 18,5. Thể tích hỗn hợp khí thu được (ở đktc) là:
A. 3,36 lít B. 2,24 lít
C. 6,72 lít D. 4,48 lít.
7. Cho 0,15 mol hỗn hợp NaHCO3 và MgCO3 tác dụng hết với dung dịch HCl. Khí thoát ra được dẫn vào dung dịch Ca(OH)2 dư thu được kết tủa có khối lượng là:
A. 8 gam B. 15 gam
C. 20 gam D. 34 gam.
8. Khử 32 gam Fe2O3 bằng khí CO dư ở nhiệt độ cao. Dẫn sản phẩm sinh ra vào bình Ca(OH)2 dư, thu được a gam kết tủa. Giá trị của a là:
A. 57,3 gam B. 58,2 gam
C. 59,0 gam D. 60,0 gam.
Advertisements (Quảng cáo)
9. Cho 24,4 gam hỗn hợp gồm Na2CO3 và K2CO3 tác dụng vừa đủ với dung dịch BaCl2, sau phản ứng thu được 39,4 gam kết tủa. Cô cạn dung dịch sau khi tách bỏ kết tủa, thu được a gam muối clorua khan. Giá trị của a là:
A. 26,6 gam B. 16,9 gam
C. 20,5 gam D. 18,5 gam
1.0. Trong phân tử của hợp chất nào sau đây, các nguyên tử cacbon cùng nằm trên một đượng thẳng?
A. CH3 – CH=CH2.
B. CH3 – CH2 –CH2 –CH3
C. CH3 –CH2 –CH3
D. \(C{H_3} – C \equiv CH\).
1.1. Cho các hợp chất: \({C_2}{H_6};{C_2}{H_2};{C_2}{H_4}{O_2};{C_2}{H_6}O;{C_6}{H_{12}}{O_6}.\) Hợp chất nào sau đây có hàm lượng cacbon cao nhất?
A. C2H6 B. C2H2
C. C6H12O6 D. C2H4O2
1.2. Đốt cháy hoàn toàn một hiđrocacbon (X) thu được \({n_{C{O_2}}} = \dfrac{1}{2}{n_{{H_2}O}}.\) Vậy X là:
A. C2H6 B. C3H6
C. CH4 D. C2H4
II. PHẦN TỰ LUẬN
13. Tính độ điện li của axit axetic trong dung dịch 0,01M; nếu trong 500ml dung dịch có 3,13.1021 phân tử và ion. Lấy số Avogađro = 6,02.1023.
14. Hòa tan 1,76 gam hỗn hợp magie và magie oxit bằng dung dịch axit clohiđric. Sau đó làm kết tủa ion Mg2+ dưới dạng muối kép MgNH4PO4 bằng hỗn hợp natri hiđrophotphat và amoniac. Sau đó đem nung kết tủa thì thu được 6,66 gam mgie điphotphat Mg2P2O7. Tính khối lượng magie và magie oxit trong hỗn hợp ban đầu.
Advertisements (Quảng cáo)
1.5. Một dung dịch CH3COOH 0,1M có độ điện li \(\alpha \) là 1,32%. Xác định hằng số phân li của axit ở trên?
1.6. Phải trộn V1 lít dung dịch axit mạnh (pH = 5) với V2 lít kiềm mạnh (pH = 9) theo tỉ lệ thể tích nào để thu được dung dịch có pH = 6?

I. PHẦN TRẮC NGHIỆM
|
Câu |
1 |
2 |
3 |
4 |
|
Đáp án |
C |
A |
C |
A |
|
Câu |
5 |
6 |
7 |
8 |
|
Đáp án |
C |
D |
B |
D |
|
Câu |
9 |
10 |
11 |
12 |
|
Đáp án |
A |
D |
B |
C |
II. PHẦN TỰ LUẬN
1.3. Cách 1:
Trong 1 lít dung dịch CH3COOH có 6,26.1021 hạt.
Trong 0,01M có 6,02.1021 phân tử.
Phương trình điện li:

Ta có: \(6,{02.10^{21}} – x + 2x = 6,{26.10^{21}} \)
\(\Rightarrow x = 0,{24.10^{21}}\)
Vậy độ điện li:
\(\alpha = \dfrac{{0,{{24.10}^{21}}}}{{6,{{02.10}^{21}}}} \times 100\% = 3,99\% .\)
Cách 2.
Phương trình điện li của axit axetic:

\( \Rightarrow 0,01 + x = \dfrac{{6,{{26.10}^{21}}}}{{6,{{02.10}^{21}}}} = 0,010399 \)
\(\Rightarrow x = 0,000399\)
Vậy độ điện li:
\(\alpha = \dfrac{{0,000399}}{{0,01}} \times 100\% = 3,99\% .\)
1.4. Các phản ứng hòa tan Mg và MgO \(\begin{array}{l}Mg + 2HCl \to MgC{l_2} + {H_2} \uparrow \\MgO + 2HCl \to MgC{l_2} + {H_2}O\end{array}\)
Phản ứng tạo kết tủa: \(MgC{l_2} + N{a_2}HP{O_4} + N{H_3} \to \)\(\,MgN{H_4}P{O_4} \downarrow + 2NaCl\)
Phản ứng phân hủy khi nung:
Để giải bài toán trên, ta không cần đến các phản ứng mà chú ý đến hai sơ đồ:
\(\begin{array}{l}2Mg \to 2M{g^{2 + }} \to 2MgN{H_4}P{O_4} \to M{g_2}{P_2}{O_7}\\2MgO \to 2M{g^{2 + }} \to 2MgN{H_4}P{O_4} \to M{g_2}{P_2}{O_7}\end{array}\)
Gọi a và b là số mol của Mg và MgO
Ta có: mhỗn hợp =24a + 40b = 1,76 (1)
Theo sơ đồ trên, ta thấy: số mol của Mg và số mol của MgO gấp 2 lần số mol Mg2P2O7. Do đó:
\(a + b = 2 \times \dfrac{{6,66}}{{222}} = 0,06{\rm{ }}\left( 2 \right)\)
Giải hệ phương trình (1) và (2), ta được: \(\left\{ \begin{array}{l}a = 0,04\\b = 0,02\end{array} \right.\)
Vậy:
Khối lượng của Mg là: \(0,04 \times 24 = 0,96\left( {gam} \right)\)
Khối lượng của MgO là: \(0,02 \times 40 = 0,8\left( {gam} \right).\)
1.5. Phương trình điện li:
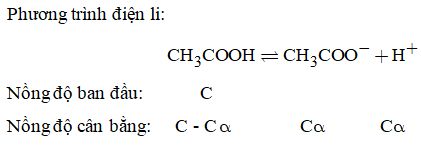
\( \Rightarrow {K_a} = \dfrac{{C\alpha \times C\alpha }}{{C – C\alpha }} = \dfrac{{C{\alpha ^2}}}{{1 – \alpha }},\) vì axit yếu nên \(1 – \alpha \approx 1\)
Do đó, \({K_a} = C{\alpha ^2} = {\left( {0,0132} \right)^2} \times 0,1 \)\(\,= 0,0000174{\rm{\; hay\; 1,74}}{\rm{.1}}{{\rm{0}}^{ – 5}}\)
1.6. \(\begin{array}{l}pH = 5 \Rightarrow \left[ {{H^ + }} \right] = {10^{ – 5}}\\pH = 9 \Rightarrow \left[ {{H^ + }} \right] = {10^{ – 9}} \Rightarrow \left[ {O{H^ – }} \right] = {10^{ – 5}}\left( {mol/l} \right)\\pH = 6 \Rightarrow \left[ {{H^ + }} \right] = {10^{ – 6}}\end{array}\)
Gọi thể tích của axit là V1 và thể tích của kiềm là V2.
Vì sau khi trộn axit dư nên số mol axit dư là: (V1 – V2).10-5 mol.
\( \Rightarrow \dfrac{{\left( {{V_1} – {V_2}} \right){{.10}^{ – 5}}}}{{{V_1} + {V_2}}} = {10^{ – 6}} \)
\(\Rightarrow \dfrac{{{V_1}}}{{{V_2}}} = \dfrac{{11}}{9}.\)






