Đề kiểm tra học kì 1 môn Hóa học lớp 11 năm học 2015 – 2016 trường THPT Quỳnh Lưu 2, Nghệ An.
1 (2,0 điểm): Cho: 50 ml dd HNO3 0,1 M (dd A),
100 ml dd Ba(OH)2 0,05M (dd B)
a. Viết phương trình điện li của HNO3; Ba(OH)2.
b. Tính pH của dd A và dd B.
c. Tính pH khi trộn lẫn dd A và dd B.
2 (2,0 điểm): Viết phương trình phân tử, phương trình ion rút gọn của các phản ứng sau:
a) FeSO4 + NaOH b) NaNO3 + CuSO4
c) HClO + KOH d) FeS(r) + HCl
3 (2,0 điểm): Hoàn thành chuỗi phản ứng sau (ghi rõ điều kiện nếu có):
4 (2,0 điểm): Cho 13,05 gam hỗn hợp Mg và Al vào dung dịch HNO3 loãng, dư thu được 10,08 lít (đktc) khí NO (sản phẩm khử duy nhất).
a) Tính thành phần % khối lượng mỗi kim loại trong hỗn hợp ban đầu.
b) Thay hỗn hợp kim loại bằng Fe dư và Cu rồi cho vào dung dịch HNO3 loãng, thu được khí không màu, hóa nâu trong không khí. Viết các phương trình phản ứng xảy ra.
5 (2,0 điểm): Đốt cháy hợp chất hữu cơ A thu được 4,48 lít khí CO2 (đktc) và 3,6 gam H2O.
Xác định công thức phân tử của A biết:
a) A không chứa Oxi và MA = 28(g/mol).
b) A chứa Oxi và MA = 88 (g/mol).
(Cho: Mg = 24, Al = 27, H = 1, N = 14, O = 16, C = 12)
Advertisements (Quảng cáo)
ĐÁP ÁN VÀ HƯỚNG DẪN CHẤM ĐIỂM
1:
a) HNO3 → H+ + NO3– (0,25đ)
Ba(OH)2 → Ba2+ + 2 OH– (0,25đ)
b) HNO3 → H+ + NO3–
H+ = 0,1 → pH dd A = 1 (0,5đ)
Ba(OH)2 → Ba2+ + 2 OH–
OH– = 0,05*2 = 0,1 → pOH = 1 → pH = 13 (0,5đ)
c) H+ + OH– → H2O
Số mol H+ = 0,005. Số mol OH– = 0,01 vậy số mol OH– dư là = 0,005 mol
pH dd sau phản ứng = 14 – (-lg0,005/0,15) = 13,5 (0,5đ)
2:
Advertisements (Quảng cáo)
a) FeSO4 + 2 NaOH → Fe(OH)2 + Na2SO4 (0,25đ)
Fe2++ 2OH– → Fe(OH)2 (0,25đ)
b) NaNO3 + CuSO4 (không phản ứng) (0,5đ)
c) HClO + KOH → KClO + H2O (0,25đ)
HClO + OH– → ClO– + H2O (0,25đ)
d) FeS (r) + HCl → H2S + FeCl2 (0,25đ)
FeS (r) + H+ → H2S + Fe2+ (0,25đ)
3: 8 phương trình,mỗi phương trình đúng 0,25 điểm (tùy vào sự hoàn thiện hay không của bài làm để trừ điểm điều kiện phản ứng)
4:
a. Có: mhh = 24x + 27y = 13,05 (1) (0,25đ)
Số mol khí = 10,08/22,4 = 0,45(mol)
Tổng số e cho = Tổng số e nhận nên: 2x + 3y = 1,35 (2) (0,25đ)
b. Vì Fe dư và Fe hoạt động hóa học mạnh hơn Cu nên có các PTPU sau:
Fe + 4 HNO3 → Fe(NO3)3 + NO + 2 H2O (0,25đ)
2NO + O2 → 2NO2 (0,25đ)
Fe + 2 Fe(NO3)3 → 3 Fe(NO3)2 (0,25đ)
Cu+ Fe(NO3)2 → Cu(NO3)2 + Fe (0,25đ)
5: Số mol CO2 = 4,48/22,4 = 0,2 mol số mol C = 0,2 mol
Số mol H2O = 3,6/18 = 0,2 mol → số mol H = 0,4 mol
a) Gọi công thức phân tử hợp chất hữu cơ A là CxHy ta có
x:y = 0,2:0,4 → x:y = 1:2
CTĐG của A: CH2 (0,5 điểm)
CTPT (CH2)n
14n = 28 → n = 2 → CTPT C2H4 (0,5 điểm)
b) CTPT của A (CH2)n(0)X (1 điểm)
14n + 16x = 88; ta có 1 ≤ n ≤ 5
|
n |
X |
|
1 |
4,625 (loại) |
|
2 |
3,75 (loại) |
|
3 |
2,875 (loại) |
|
4 |
2 (thỏa mãn) |
|
5 |
1,125 (loại) |
Vậy CTPT A là C4H8O2


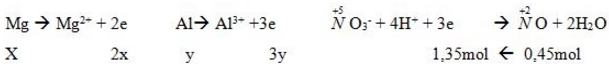


![[Lương Ngọc Quyến] Đề thi học kì II Toán 11: Tìm số hạng đầu, công sai và tổng](https://dethikiemtra.com/wp-content/uploads/2017/04/de-thi-hoc-ki-2-lop-11-mon-toan-100x75.png)



