
I. PHẦN TRẮC NGHIỆM (3đ)
1. Cho các chất: metyl fomat, glucozơ, anđehit axetic, glixerol, axetilen, fructozơ, tinh bột, axit oxalic. Số chất tác dụng với dung dịch \(AgN{O_3}\) trong \(N{H_3}\) là
A. 4.
B. 3.
C. 5.
D. 6.
2. Đun nóng lần lượt các chất sau trong dung dịch NaOH: \(C{H_3}COOCH = C{H_2},\,\) \(\,C{H_3}COOC{H_2} – C{H_3},\)\(HCOOC{H_{_3}},\)\(\,C{H_3}COOC{H_2} – CH = C{H_2},\)\(\,C{H_3}C{H_2}Cl,\)\(\,C{H_2} = CH – Cl.\)Số chất bị thủy phân cho sản phẩm có phản ứng tráng bạc là
A. 3.
B. 2.
C. 4.
D. 1.
3. Dãy gồm các chất nào sau đây đều có phản ứng thủy phân?
A. Etyl clorua, etyl axetat, axit axetic, saccarozơ, tinh bột, chất béo.
B. Chất béo, mantozơ, xenlulozơ, glucozơ, tinh bột, benzyl clorua.
C. Chất béo, mantozơ, xenlulozơ, etyl axetat, tinh bột, benzyl clorua.
D. Etyl clorua, etyl axetat, phenol, saccarozơ, xenlulozơ, chất béo.
4. Thủy phân hoàn toàn 0,1 mol saccarozơ, thu được dung dịch A. Cho lượng dư \(AgN{O_3}/N{H_3}\) vào dung dịch A, sau khi phản ứng xảy ra hoàn toàn thu được m gam kết tủa. Giá trị của m là.
A. 21,6 gam.
B. 43,2 gam.
C. 10,8 gam.
D. 4,32 gam.
5. Từ một tấn bột sản xuất được V lít rượu \(30^\circ .\) Biết hiệu suất của quá trình là 60% và khối lượng riêng của \({C_2}{H_5}OH\) là 0,8 g/ml. Giá trị của V là
A. 1417,5
B. 2125.
C. 2370,8
D. 141,75
6. Saccarozơ, glucozơ, fructozơ đều phản ứng với dung dịch hoặc chất nào sau đây?
Advertisements (Quảng cáo)
A. Dung dịch \(AgN{O_3}/N{H_3}.\)
B. Nước brom.
C. \(Cu{(OH)_2}.\)
D. Dung dịch NaOH.
II. PHẦN TỰ LUẬN (7 điểm)
1. (1đ) Từ tinh bột và các chất vô cơ cần thiết hãy viết phương trình điều chế etyl axetat.
2. (1,5đ) Chọn các thuốc thử thích hợp phân biệt các dung dịch riêng biệt sau bằng phương pháp hóa học: glucozơ, fructozơ, saccarozơ. Không cần viết phương trình phản ứng.
3. (1,5đ) Ba chất hữu cơ A, B, C đơn chức đều có công thức phân tử \({C_3}{H_6}{O_2}.\) Biết:
+ A dễ tan trong nước và có nhiệt độ sôi cao hơn nhiều B và C.
+ B có khả năng tráng bạc với \(AgN{O_3}/N{H_3}.\)
+ C không tráng bạc và không tan trong nước.
Xác định công thức cấu tạo của A, B, C và viết các phương trình xảy ra.
4. (3đ). Đốt cháy hoàn toàn 4,4 gam một ete tạo ra từ axit no, đơn chức và ancol no, đơn chức, cần V lít oxi. Sau phản ứng thu được 4,48 lít khí \(C{O_2}.\) Biết các thể tích đều đo ở đktc.
a) Tính V.
b) Lập công thức phân tử của E.
c) Thủy phân hoàn toàn 4,4 gam E bằng dung dịch NaOH vừa đủ, sau đó cô cạn dung dịch thấy có 4,1 gam muối khan. Xác định công thức cấu tạo của E.

Advertisements (Quảng cáo)
| 1 | 2 | 3 | 4 | 5 | 6 |
| C | B | C | B | A | C |

I) Trắc nghiệm
1. Chọn C.
Gồm những chất có nhóm –CH=O hoặc \( – C \equiv CH\): metyl fomat, glucoz, anđehit axetic, axetilen, fructozơ (môi trường kiềm chuyển thành glucozơ).
2. Chọn B.
2 este là: \(C{H_3}COOCH = C{H_2},HCOOC{H_3}\)
(\(C{H_2} = CH – Cl\) không bị thủy phân).
3. Chọn C.
4. Chọn B.
0,1 mol saccarozơ (đisaccarit) thủy phân cho 0,2 mol monosaccarit (glucozơ và fructozơ) đều tráng bạc cho 0,4 mol Ag.
5. Chọn A.
\({({C_6}{H_{_{10}}}{O_5})_n} \to n{C_6}{H_{12}}{O_6} \to 2n{C_2}{H_5}OH\)
162 tấn 92 tấn
1 tấn 0,5679 tấn
Vì H = 60% nên chỉ thu được 0,5679.60% = 0,3402 tấn = 340200 gam.
Thể tích etanol \( = \dfrac{m}{d} = \dfrac{{340200}}{{0,8}} = 425250ml = 425,25\) lít.
Thể tích rượu \(30^\circ \) là \( = 425,25.\dfrac{{100}}{{30}} = 1417,5\) (lít).
6. Chọn C.
II. PHẦN TỰ LUẬN (7đ)
1. (1đ) Các phản ứng điều chế:
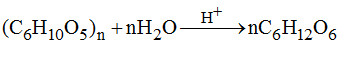
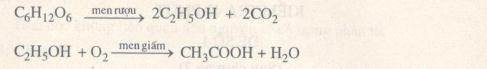
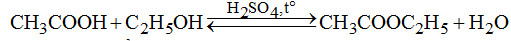
2. (1,5đ) Các thuốc thử là dung dịch brom và \(AgN{O_3}/N{H_3}\)
+ Chỉ glucozơ làm mất màu nước brom.
+ fructozơ tráng bạc.
+ Saccarozơ không phản ứng.
3. (1,5đ).
Vì A, B, C đơn chức mà phân tử có 2O nên phải là axit hoặc este.
A là axit \({C_2}{H_5}OH\): vì có liên kết hiđro nên dễ tan trong nước và có nhiệt độ sôi cao nhất.
B là este \(HCOO{C_2}{H_5}\) (có nhóm –CH=O) nên tráng bạc.
C là \(C{H_3}COOC{H_3}.\)
4. (3đ) a) Este no đơn chức
\({C_n}{H_{2n}}{O_2} + \dfrac{{3n – 2}}{2}{O_2} \to nC{O_2} + n{H_2}O\)
Số mol \({H_2}O\) = số mol \(C{O_2}\) = 0,2 mol
Theo định luật bảo toàn khối lượng:
\({m_{{O_2}}} = {m_{C{O_2}}} + {m_{{H_2}O}} – {m_A} = 8gam\)
\({V_{oxi}} = 5,6\) (lít).
b) theo định luật bảo toàn nguyên tố oxi:
Số mol este = số mol \(C{O_2} + \dfrac{1}{2}\) số mol \({H_2}O\) – số mol \({O_2} = 0,05mol\)
\({M_{este}} = 14n + 32 = 88 \Rightarrow n = 4 \Rightarrow \) este là \({C_4}{H_8}{O_2}\)
c) Số mol muối = số mol este = 0,05 mol
\({M_{RCOONa}} = {M_R} + 67 = 82 \Rightarrow R = 15.\) R là \(CH_3^ – \)
Công thức của este là \(C{H_3}COO{C_2}{H_5}.\)






