I. PHẦN TRẮC NGHIỆM (3đ)
1. Phản ứng diễn ra trong quá trình luyện thép là
A. oxi hóa các tạp chất bằng oxi.
B. khử các oxit sắt.
C. oxi hóa bớt sắt thành oxit.
D. trộn thêm Fe tinh khiết vào gang.
2. Chất nào sau đây không tác dụng với Cu?
A. \({H_2}S{O_4}\) đặc nóng.
B. Dung dịch \(AgN{O_3}\)
C. Dung dịch HCl loãng.
D. Khí \(C{l_2}/t^\circ .\)
3. Cho một oxit sắt vào dung dịch thuốc tím có pha \({H_2}S{O_4}\) dư thấy dung dịch không mất màu. Oxit đó là
A. FeO.
B. \(F{e_3}{O_4}.\)
C. \(F{e_2}{O_3}.\)
D. tất cả các oxit.
4. Phản ứng nào sau đây chứng tỏ \(F{e^{2 + }}\) có tính khử yếu hơn so với Cu
\(\begin{array}{l}A.\,Fe + C{u^{2 + }} \to F{e^{2 + }} + Cu \downarrow \\B.\,F{e^{2 + }} + Cu \to C{u^{2 + }} + Fe \downarrow \\C.\,2F{e^{3 + }} + Cu \to 2F{e^{2 + }} + C{u^{2 + }}\\D.\,C{u^{2 + }} + 2F{e^{2 + }} \to 2F{e^{3 + }} + Cu\end{array}\)
5. Chất còn thiếu trong phản ứng:
\(NaCr{O_2} + B{r_2} + NaOH \to … + NaBr + {H_2}O\) là:
Advertisements (Quảng cáo)
A. \(N{a_2}C{r_2}{O_7}.\)
B. \(N{a_2}Cr{O_4}.\)
C. \(CrB{r_3}.\)
D. A, B đều đúng.
6. Quá trình điều chế Zn từ quặng \(ZnC{O_3}.ZnS\) bằng phương pháp điện phân không có phản ứng:
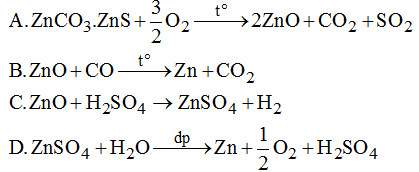
II. PHẦN TỰ LUẬN (7đ)
1. (2đ)
Cho sơ đồ chuyển hóa với X, Y, Z, M, E là các hợp chât của Fe. X chứa 2 nguyên tố. E có màu nâu đỏ.
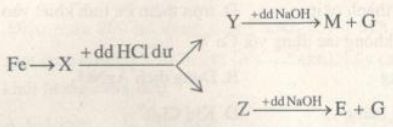
Xác định các chất và viết phương trình phản ứng minh họa.
2. (2đ)
Chỉ dùng kim loại đồng, hãy nhận biết các dung dịch: \(HN{O_3}\) loãng, \(AgN{O_3},HCl.\)
Advertisements (Quảng cáo)
3. (3đ)
Cho luồng khí CO dư đi qua ống sứ đựng hỗn hợp hai oxit kim loại là XO và YO đun nóng đến phản ứng hoàn toàn, thu được 17,6 gam hỗn hợp hai kim loại. Khí thoát ra cho đi vào bình đựng dung dịch \(Ca{(OH)_2}\) dư thấy tạo ra 30 gam kết tủa. Cho hỗn hợp kim loại vào HCl dư thu được 4,48 lít khí ở điều kiện tiêu chuẩn và còn lại 6,4 gam kim loại Y không tan. Hóa trị của X và Y trong các phản ứng không thay đổi.
a) Tìm hai kim loại X, Y.
b) Hòa tan hai oxit trên vào dung dịch \(HN{O_3}\) loãng dư. Tính thể tích khí (đktc) và khối lượng muối thu được.

1. Chọn A.
Oxi hoá các nguyên tố khác (C, Si, P, Mn,… ) có trong gang để giảm % khối lượng của chúng, sẽ thu được thép.
B sai: Quá trình khử oxit sắt diễn ra trong quá trình luyện gang.
C sai: \({O_2}\) phải ngừng cung cấp khi Fe vừa bắt đầu bị oxi hoá.
2. Chọn C.
3. Chọn C.
\(F{e_2}{O_3} + 3{H_2}S{O_4} \to F{e_2}{(S{O_4})_3} + 3{H_2}O\)
4. Chọn C.
(Chất khử mạnh là Cu, sinh ra chất khử yếu là Fe).
5. Chọn B.
\(C{r^{3 + }}\) bị \(B{r_2}\) oxi hóa \( \to \) phải thành \(C{r^{ + 6}}.\)
\(N{a_2}C{r_2}{O_7}\) không bền trong môi trường kiềm \( \to \) chất cần tìm phải là \(N{a_2}Cr{O_4}.\)
6. Chọn B.
Vì chỉ có ở phương pháp nhiệt luyện.
II. PHẦN TỰ LUẬN (7đ)
1. (2đ)
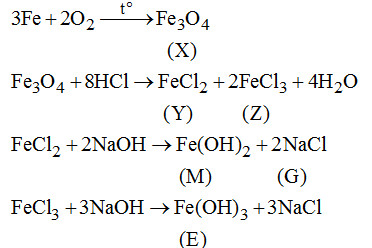
2. (2đ).
Dung dịch \(HN{O_3}\) cho khí không màu:
\(3Cu + 8HN{O_3} \to 3Cu{(N{O_3})_2} + 2NO + 4{H_2}O\)
Dung dịch \(AgN{O_3}\) cho kim loại bạc màu trắng bám xung quanh kim loại Cu.
\(Cu + 2AgN{O_3} \to Cu{(N{O_3})_2} + 2Ag\)
Còn lại là dung dịch HCl.
3. (3đ)
\(\begin{array}{l}a){n_{{H_2}}} = 0,2mol;{n_{CaC{O_3}}} = 0,3mol\\XO + CO \to X + C{O_2}\\YO + CO \to Y + C{O_2}\\C{O_2} + Ca{(OH)_2} \to CaC{O_3} + {H_2}O\\X + 2HCl \to XC{l_2} + {H_2}\\{m_X} = 17,6 – 6,4 = 11,2(g);\\{n_X} = {n_{{H_2}}} = 0,2mol\\ \Rightarrow X = \dfrac{{11,2}}{{0,2}} = 56g/mol \Rightarrow X(Fe)\\{n_Y} + {n_X} = {n_{C{O_2}}} = {n_{CaC{O_3}}} = 0,3mol\\ \Rightarrow {n_Y} = 0,1mol\\ \Rightarrow Y = \dfrac{{6,4}}{{0,1}} = 64g/mol \Rightarrow Y(Cu).\\b)CuO + 2HN{O_3} \to Cu{(N{O_3})_2} + {H_2}O\\3FeO + 10HN{O_3} \to 3Fe{(N{O_3})_3} + NO + 5{H_2}O\\{n_{NO}} = \dfrac{1}{3}{n_{FeO}} = \dfrac{{0,2}}{3}\\ \Rightarrow {V_{NO}} = 14,93(l)\\{m_m} = {m_{Fe{{(N{O_3})}_3}}} + {m_{Cu{{(N{O_3})}_2}}} \\\;\;\;\;\;\;\;= 0,1.188 + 0,2.242 = 67,2gam.\end{array}\)