
I. PHẦN TRẮC NGHIỆM
1. Để khử hoàn toàn 17,6 gam hỗn hợp rắn gồm: Fe, FeO, Fe3O4 và Fe2O3 cần vừa đủ 2,24 lít CO (đktc). Khối lượng Fe thu được là:
A.14 gam B.15 gam
C.16 gam D.18 gam
2. Cho V lít CO2 (đktc) vào dung dịch chứa 0,2 mol Ca(OH)2 thu được 10 gam kết tủa. Giá trị của V là:
A.1,12 lít B.2,24 lít
C.6,72 lít D.Cả B và C đều đúng.
3. Thổi một luồng khí CO dư qua ống sứ đựng a gam hỗn hợp Fe3O4 và CuO nung nóng đến khi phản ứng xảy ra hoàn toàn, thu được 2,32 gam hỗn hợp kim loại. Dẫn khí thoát ra vào dung dịch nước vôi trong dư thu được 5 gam kết tủa. Giá trị của a là:
A.3,12 gam B.2,22 gam
C.3,32 gam D.1,54 gam
4. Trong một bình kín thể tích không đổi chứa bột S và C (thể tích không đáng kể). Bơm không khí vào bình đến áp suất 2atm ở \(15^\circ C\). Bật tia lửa điện để S và C cháy thành SO2 và CO2, sau đó đưa bình về \(25^\circ C\). Áp suất trong bình lúc đó là:
A.1,5atm B.2,0atm
C.2,5atm D.1,0atm
5. Hai dạng tồn tại khác nhau của cùng một đơn chất được gọi là:
A. công thức phân tử.
B. thù hình
C. đơn chất
D. đồng vị.
Advertisements (Quảng cáo)
6. Cấu hình electron nào sau đây là của cacbon?
A. 1s22s22p2 B. 1s22s22p3
C. 1s22s22p1 D. 1s22s13d2
7. Dãy chất nào sau đây phản ứng được với cacbon?
A.CuO, ZnO, CO2, H2, HNO3 đặc, H2SO4 đặc
B. Al2O3, K2O, Ca, HNO3, H2SO4 đặc
C. CuO, Na2O, CO2, HNO3 đặc, H2SO4 đặc.
D.Ag2O, BaO, Al, HNO3 đặc, H2SO4 đặc, CO2
8. Dãy nguyên tố nào sau đây được sắp xếp theo chiều giảm dần của tính kim loại?
\(\begin{array}{l}A.C,Si,Pb,S,Ge\\B.C,Pb,Sn,Ge,Si\end{array}\)
\(\begin{array}{l}C.Pb,Sn,Ge,Si,C\\D.Pb,Sn,Si,Ge,C\end{array}\)
II. PHẦN TỰ LUẬN
Advertisements (Quảng cáo)
9. Để đốt cháy 68 gam hỗn hợp hiđro và cacbon mono oxit cần 89,6 lít oxi (đktc). Xác định thành phần phần trăm theo thể tích của mỗi khí trong hỗn hợp ban đầu.
10. Cho 32 gam oxit sắt tác dụng hoàn toàn với khí cacbon mono oxit thì thu được 22,4 gam sắt . Hỏi công thức phân tử của oxit sắt đem dùng là gì?
11. Khi phân hủy 4,84 gam hỗn hợp NaHCO3 và KHCO3 thì thu được 0,56 lít khí CO2 (đktc). Xác định thành phần phần trăm mỗi muối trong hỗn hợp đầu và khối lượng hỗn hợp muối thu được sau phản ứng.

I. PHẦN TRẮC NGHIỆM
|
Câu |
1 |
2 |
3 |
4 |
|
Đáp án |
C |
D |
A |
B |
|
Câu |
5 |
6 |
7 |
8 |
|
Đáp án |
B |
A |
A |
C |
II. PHẦN TỰ LUẬN
9. Ta có: \({n_{{O_2}}} = \dfrac{{89,6}}{{22,4}} = 4\left( {mol} \right)\)
Phản ứng: \(\begin{array}{l}2CO + {O_2} \to 2C{O_2}{\rm{ }}\left( 1 \right)\\2{H_2} + {O_2} \to 2{H_2}O{\rm{ }}\left( 2 \right)\end{array}\)
Gọi x là số mol của O2 tham gia phản ứng (1)
Suy ra, số mol O2 tham gia phản ứng (2) là (4 – x) mol
Từ (1) và (2) \( \Rightarrow {n_{CO}} = 2x\left( {mol} \right);\)\(\,{n_{{H_2}}} = 2\left( {4 – x} \right)mol\)
Mà: mhỗn hợp khí \( = {m_{{H_2}}} + {m_{CO}}\)
\(\begin{array}{l} \Leftrightarrow 68 = 2 \times 2\left( {4 – x} \right) + 28 \times 2x\\ \Leftrightarrow 68 = 16 – 4x + 56x \Rightarrow x = 1\end{array}\)
Vì là chất khí nên %V = %n
Vậy: \(\% {V_{{H_2}}} = \% {n_{{H_2}}} = \dfrac{9}{8} \times 100\% = 75\% \)
\(\% {V_{CO}} = \% {n_{CO}} = 100\% – 75\% = 25\% .\)
10. Ta có: \({n_{Fe}} = \dfrac{{22,4}}{{56}} = 0,4\left( {mol} \right)\)
\(\begin{array}{l}F{e_x}{O_y} + yCO \to xFe + yC{O_2}\\\left( {56x + 16y} \right)gam{\rm{ \;\;\;\;\;\;\;\;\;\;\;\;\;\; x mol}}\\{\rm{32 gam \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\; 0,4 mol}}\end{array}\)
\( \Rightarrow \dfrac{{56x + 16y}}{{32}} = \dfrac{x}{{0,4}} \Rightarrow \dfrac{x}{y} = \dfrac{2}{3}\)
Suy ra công thức oxit sắt là: Fe2O3.
11. Ta có: \({n_{C{O_2}}} = \dfrac{{0,56}}{{22,4}} = 0,025\left( {mol} \right)\)
Gọi a là số mol của NaHCO3 và b là số mol của KHCO3
Phản ứng:
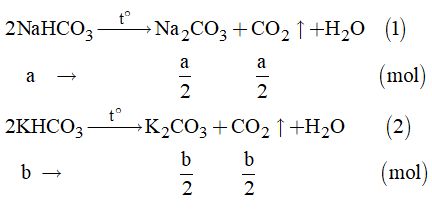
Theo đề bài, ta có hệ phương trình:
\(\left\{ \begin{array}{l}\dfrac{a}{2} + \dfrac{b}{2} = 0,025\\84a + 100b = 4,84\end{array} \right.\)
Giải hệ phương trình, ta được: \(\left\{ \begin{array}{l}a = 0,01\\b = 0,04\end{array} \right.\)
Vậy: \(\% {m_{NaHC{O_3}}} = \dfrac{{0,01 \times 84}}{{4,84}} \times 100\% \)\(\, = 17,36\% \)
\(\% {m_{KHC{O_3}}} = \dfrac{{0,04 \times 100}}{{4,84}} \times 100\% \)\(\, = 82,64\% \)
\( \Rightarrow \) mmuối \( = {m_{N{a_2}C{O_3}}} + {m_{{K_2}C{O_3}}} \)\(\,= \dfrac{a}{2}.106 + \dfrac{b}{2}.138 = 3,29\left( {gam} \right)\).






