
I. PHẦN TRẮC NGHIỆM
1. Hỗn hơp X gồm 2 khí N2 và H2 theo tỉ lệ mol là 1 : 4. Nung X với xúc tác ở nhiệt độ cao thu được hỗn hợp khí Y, trong đó NH3 chiếm 20% thể tích. Hiệu suất phản ứng trên là:
A. 41,67% B. 45,00%
C. 35,67% D. 50,60%
2. Cho phản ứng oxi hóa – khử sau:
\(Al + HN{O_3} \to Al{\left( {N{O_3}} \right)_3} + {N_2}O \uparrow \)\(\, + {N_2} \uparrow + {H_2}O\)
Nếu tỉ lệ giữa N2O và N2 là 2 : 3 thì sau khi cân bằng tỉ lệ số mol \({n_{Al}}:{n_{{N_2}O}}:{n_{{N_2}}}\)là dãy nào sau đây?
\(\begin{array}{l}A.23:4:6\\B.46:2:3\end{array}\) \(\begin{array}{l}C.46:6:9\\D.20:5:4\end{array}\)
3. Cho hỗn hợp X gồm Al và Fe tác dụng với dung dịch gồm AgNO3 và Cu(NO3)2 thu được dung dịch Y và chất rắn Z gồm 3 kim loại. Thành phần của chất rắn Z là:
\(\begin{array}{l}A.Al;Fe;Cu\\B.Al;Cu;Ag\end{array}\) \(\begin{array}{l}C.Al;Fe\\D.Fe;Cu;Ag\end{array}\)
4. Cho FeS2 tác dụng với dung dịch HNO3 đặc, nóng tạo ra khí NO2. Tổng hệ số của các chất sau khi phản ứng thu được cân bằng là:
A.44 B.43
C.42 D.41
5. Cấu hình electron lớp ngoài cùng của nguyên tử một nguyên tố thuộc nhóm VA có dạng tổng quát là:
A.ns2np3 B.ns1np4
C.ns2nd2np1 D.ns2np5
6. Tổng số hạt proton, nơtron, electron của nguyên tử một nguyên tố Y là 21. Tổng số obitan nguyên tử (có chứa electron) của nguyên tố đó là:
Advertisements (Quảng cáo)
A.3 obitan C.4 obitan
C.5 obitan D.2 obitan.
7. Dãy nào sau đây biểu thị đầy đủ các số oxi hóa cơ bản của nitơ?
\(\begin{array}{l}A. – 1;0; + 4; + 5; + 6\\B. – 4; – 3;0; + 2\\C. – 3;0; + 1; + 2; + 3; + 4; + 5\\D. + 1; + 2; + 3; + 4; + 5\end{array}\)
8. Để phân biệt 4 lọ không dán nhãn được đựng riêng biệt từng khí sau: O2; N2; H2S; và Cl2 người ta có thể chọn trình tự tiến hành nào sau đây?
A. Dùng đốm lửa đỏ, dùng giấy tẩm Pb(NO3)2, dùng giấy màu ẩm.
B. Đốt các khí, dùng giấy quỳ ẩm
C. Dùng tàn đóm đỏ, đốt các khí
D. Dùng tàn đóm đỏ, dùng giấy tẩm NaOH, dùng giấy màu ẩm.
II. PHẦN TỰ LUẬN
9. Một hỗn hợp X chứa 100 mol gồm N2 và H2 tỉ lệ 1: 3. Áp suất ban đầu là 300 atm. Sau phản ứng tạo amoniac, áp suất giảm còn 285 atm, nếu nhiệt độ phản ứng được giữ không đổi thì hiệu suất phản ứng là bao nhiêu?
Advertisements (Quảng cáo)
10. Đồng nitrat bị phân hủy khi nung theo phản ứng: \(Cu{\left( {N{O_3}} \right)_2} \to CuO + 2N{O_2} \uparrow + \frac{1}{2}{O_2} \uparrow \)
Khi nung 15,04 gam đồng nitrat thấy còn lại 8,56 gam chất rắn. Hãy xác định phần trăm đồng nitrat bị phân hủy và thành phần chất rắn còn lại.
11. Hòa tan hoàn toàn 20,8 gam hợp kim Sắt – Đồng bằng dung dịch HNO3 đặc, nóng, dư thu được 20,16 lít khí NO2 (đktc). Xác định thành phần phần trăm theo khối lượng mỗi kim loại trong hợp kim ban đầu.

I. PHẦN TRẮC NGHIỆM
|
Câu |
1 |
2 |
3 |
4 |
|
Đáp án |
A |
C |
D |
A |
|
Câu |
5 |
6 |
7 |
8 |
|
Đáp án |
A |
C |
C |
A |
II. PHẦN TỰ LUẬN
9.
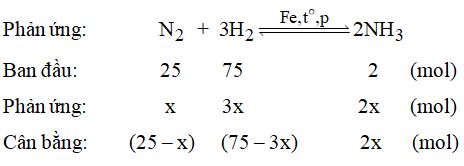
Tổng số mol sau phản ứng: 100 – 2x (mol)
Ta có tỉ lệ:
\(\begin{array}{l}\dfrac{{{p_t}}}{{{p_s}}} = \dfrac{{{n_t}}}{{{n_s}}}\\ \Rightarrow {n_s} = \dfrac{{285 \times 100}}{{300}} = 95\left( {mol} \right)\\{\rm{ }} \Rightarrow 100 – 2x = 95 \Rightarrow x = 2,5\left( {mol} \right)\end{array}\)
Vậy hiệu suất \(H = \dfrac{{2,5}}{{25}} \times 100\% = 10\% \)
10. Ta có: \({n_{Cu{{\left( {N{O_3}} \right)}_2}}} = \dfrac{{15,04}}{{188}} = 0,08\left( {mol} \right)\)
Phản ứng: \(Cu{\left( {N{O_3}} \right)_2} \to 2CuO + 4N{O_2} \uparrow + {O_2} \uparrow {\rm{ }}\left( 1 \right)\)
Gọi a là số mol của Cu(NO3)2 phản ứng
Suy ra số mol của Cu(NO3)2 còn dư là: (0,08 – a) mol
Từ (1) \( \Rightarrow {n_{CuO}} = a\left( {mol} \right)\)
Theo đề bài, ta có phương trình:
mchất rắn = \({m_{CuO}} + {m_{Cu{{\left( {N{O_3}} \right)}_2}}}\)dư
\(\begin{array}{l} \Leftrightarrow 8,56 = 80a + 188\left( {0,08 – a} \right)\\ \Leftrightarrow 8,56 = 80a + 15,04 – 188a\\ \Rightarrow a = \dfrac{{6,48}}{{108}} = 0,06\end{array}\)
Vậy:
+) Phần trăm đồng nitrat bị phân hủy là: \(\dfrac{{0,06}}{{0,08}} \times 100\% = 75\% \)
+) Thành phần chất rắn: CuO (0,06 mol) và Cu(NO3)2 dư (0,02 mol)
1.1. Ta có: \({n_{N{O_2}}} = \dfrac{{20,16}}{{22,4}} = 0,9\left( {mol} \right)\)
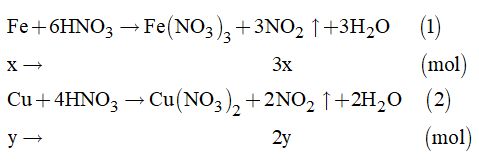
Theo đề bài, ta có hệ phương trình:
\(\left\{ \begin{array}{l}56x + 64y = 20,8\\3x + 2y = 0,9\end{array} \right. \Leftrightarrow \left\{ \begin{array}{l}x = 0,2\\y = 0,15\end{array} \right.\)
Vậy \(\begin{array}{l}\% {m_{Fe}} = \dfrac{{0,2 \times 56}}{{20,8}} \times 100\% = 53,85\% \\\% {m_{Cu} = 100\% – 53,85\% = 46,15\% }\end{array}\)






