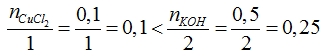Đề kiểm tra học kì 1 lớp 9 môn Hóa học: Chỉ dùng một thuốc thử nào sau đây có thể phân biệt đồng thời các chất khí để riêng biệt: Oxi, Clo, Hiđro chorua?
PHÒNG GIÁO DỤC VÀ ĐÀO TẠO THÀNH PHỐ MÓNG CÁI
ĐỀ KIỂM TRA HỌC KÌ 1
Môn: Hóa Học – lớp 9
Năm học 2016 – 2017
Thời gian làm bài 45 phút
1 ( 3,0 điểm). Em hãy chọn phương án trả lời đúng rồi ghi vào bài làm.
1.1. Dãy các kim loại nào sau đây được sắp xếp theo chiều hoạt động hóa học giảm dần?
A. Cu, Ag, Fe, Al, Mg, K
B.K, Mg, Al, Fe, Cu, Ag.
C.Ag, Cu, Fe, Al, Mg, K.
D.K, Mg, Al, Cu, Ag, Fe.
1.2. Chỉ dùng một thuốc thử nào sau đây có thể phân biệt đồng thời các chất khí để riêng biệt: Oxi, Clo, Hiđro chorua?
A. Dung dịch axit clohiđric.
B.Dung dịch bạc nitrat.
Advertisements (Quảng cáo)
C.Dung dịch bari clorua.
D.Quỳ tím ẩm.
1.3. Cặp chất nào sau đây phản ứng tạo ra dung dịch có màu vàng nâu?
A. Fe và dung dịch HCl.
B.CuO và dung dịch HNO3.
C.Fe(OH)3 và dung dịch H2SO4.
D.Fe(OH)2 và dung dịch H2SO4.
1.4. Khí CO được dùng làm chất đốt trong công nghiệp bị lẫn các tạp chất là các khí CO2, SO2, Cl2, HCl. Để làm sạch khí CO người ta dùng …
A. dung dịch Ca(OH)2 dư.
B.dung dịch NaCl dư.
C.dung dịch HCl dư.
D.nước dư.
Advertisements (Quảng cáo)
1.5. Cho từ từ dung dịch NaOH vào dd FeCl3, lọc lấy kết tủa nung trong không khí đến khối lượng không đổi thu được chất rắn A. Chất rắn A là:
A. Fe(OH)2
B.Fe2O3
C.FeO
D.Fe3O4
1.6. Dung dịch nhôm clorua bị lẫn tạp chất là dung dịch CuCl2 và ZnCl2. Dùng chất nào sau đây để làm sạch dung dịch nhôm clorua?
A. Fe.
B.Cu.
C.Ag.
D.Al.
2 (2,5 điểm).
Viết các phương trình hoá học thực hiện những chuyển đổi hoá học sau:
3 (4,0 điểm).
Cho 23,5 gam K2O vào nước để thu được 500 ml dung dịch bazơ.
a) Tính nồng độ mol của dung dịch bazơ thu được.
b) Tính khối lượng dung dịch H2SO4 20% cần để trung hòa dung dịch bazơ nói trên.
c) Nếu cho 100 ml dung dịch CuCl2 1M vào dung dịch bazơ nói trên thì thu được bao nhiêu gam kết tủa?
4 (0,5 điểm).
Tại sao không nên dùng những đồ vật bằng nhôm để đựng vôi tôi, vữa xây dựng?
( Cho: K = 39, H = 1, Cu = 64, Cl = 35,5, S = 32, O = 16)
***** HẾT ******
ĐÁP ÁN VÀ HƯỚNG DẪN CHẤM
| Câu |
Sơ lược đáp án |
Điểm |
| 1
(3,0 điểm) |
1- B
2- D 3- C 4- A 5- B 6- D |
0,5×6
|
| 2
(2,5 điểm) |
1. 2 Cu + O2 -t°→ 2 CuO
2. CuO + H2SO4 → CuSO4 + H2O 3. CuSO4 + BaCl2 → CuCl2 + BaSO4 4. CuCl2 + 2AgNO3 → Cu(NO3)2 + 2 AgCl 5. Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2 NaNO3 |
0,5 x 5
|
| 3
(4,0 điểm) |
a) nKO = 23,5/94 = 0,25 mol
PTHH: K2O + H2O → 2 KOH (1) 0,25 0,5 (mol) => CM(NaOH) = 0,5/0,5 = 1M |
0,25
0,5 0,25 0,25 |
| b) PTHH: 2 KOH + H2SO4 → K2SO4 + 2 H2O (2)
0,5 → 0,25 (mol) m HSO= 0,25 . 98 = 24,5 g mdd HSO= 24,5 . 100/20 = 122,5 g |
0, 5
0,25 0,25 0,25 |
|
| c) nCuCl= 0,1 . 1 = 0,1 mol
PTHH: CuCl2 + 2KOH → Cu(OH)2 + 2 KCl (3) => KOH dư, tính theo CuCl2. nCu(OH)= nCuCl= 0,1 mol => mCu(OH)= 0,1 . 98 = 9,8 g |
0,25
0,5 0,25 0,25 0,25 |
|
| 4
(0,5 điểm) |
Vì nhôm có thể phản ứng với Ca(OH)2 có trong vôi tôi, vữa xây dựng. | 0,5 |