Đề thi gồm 2 phần tự luận và trắc nghiệm. Nội dung xoay quanh kiến thức Hóa học 8. Để làm tốt đề này các em cần nắm chắc các kiến thức sau:
1. Oxi – không khí:
| – Biết phương pháp điều chế oxi trong phòng thí nghiệm; khái niệm phản ứng phân hủy.Sự oxi hóa,sự oxi hóa chậm. | – Phân biệt được axit ,bazơ, muối.
|
2. Hidro, nước, phản ứng thế, phân loại hợp chất vô cơ
| – Biết được tính chất hóa học của hiđro;
-Biết phân biệt đâu là oxit,axít,bazơ ,muối – Tính chất hóa học của nước. – Tính thể tích khí H2 (đktc) |
-Viết các phương trình phản ứng theo dãy chuyển hóa.
|
3. Dung dịch và nồng độ dung dịch
| – Biết phân biệt dung môi,chất tan,dung dịch- nồng độ C%,CM. | – Làm bài tập tính theo phương trình hóa học. | Biết làm bài tập tính theo PTHH. |
II/ĐỀ BÀI:
Phần A. Trắc nghiệm
Câu I. Khoanh tròn vào một trong các chữ A, B, C hoặc D đứng trước phương án đúng nhất trong các câu sau:
1. Sự oxi hoá chậm là:
A. Sự oxi hoá toả nhiệt mà không phát sáng.
B. Sự oxi hoá mà không phát sáng.
C. Sự oxi hoá mà không toả nhiệt.
D. Sự tự bốc cháy.
2. Phản ứng nào dưới đây thuộc loại phản ứng phân hủy ?
A. CO2 + Ca(OH)2 → CaCO3 + H2O
B. CaO + H2O → Ca(OH)2
C. 2KClO3 t0 → 2KCl + 3O2
D. CuO + H2 → t0 Cu + H2O
3. Cho phản ứng sau: HgO + H2 Hg + H2 Khí Hiđro thể hiện tính gì trong phản ứng trên:
A. Khí Hiđro là chất oxi hoá. B. Khí Hiđro chất tan
C. Khí Hiđro là chất cháy D. Khí Hiđro là chất khử.
4. Khử hết 2,0 g đồng (II) oxit bằng khí hiđro ở nhiệt độ cao. Thể tích khí hiđro(ở đktc) cần dùng là:
A. 56 lít B. 5,6 lít C. 0,56 lít D.0,056 lít
5. Nhóm các chất nào sau đây đều là oxit ?
Advertisements (Quảng cáo)
A. Na2O, CO2 , FeO, P2O5
B. Ca(OH)2, Al2O3, H2SO4, NaOH
C. MgCl2, NaHCO3, K2SO4, Ca(NO3)2
D. NaOH, Ca(OH)2, Mg(OH)2, KOH
6. Khi hòa tan muối CuSO4 vào nước thì
A. muối CuSO4 là dung môi.
B. nước là dung dịch.
C. muối CuSO4 là chất tan.
D.nước là chất tan.
7. Để tính nồng độ mol của dung dịch NaOH, người ta làm thế nào?
A. Tính số gam NaOH có trong 100g dung dịch
B. Tính số gam NaOH có trong 1 lít dung dịch
C. Tính số gam NaOH có trong 1000g dung dịch
D. Tính số mol NaOH có trong 1 lít dung dịch
8. Câu nào đúng khi nói về nồng độ phần trăm?
Advertisements (Quảng cáo)
Nồng độ phần trăm là nồng độ cho biết:
A.Số gam chất tan có trong 100g dung dịch
B. Số gam chất tan có trong 100g dung dịch bão hoà
C. Số gam chất tan có trong 100g nước
D. Số gam chất tan có trong 1 lít dung dịch
Câu II.dùng cụm từ “ oxit axit;oxit bazơ; nguyên tố; hiđrô; nguyên tử hiđrô; oxi; kim loại; gốc axit” đề điền vào chỗ trống:
1.Nước là hợp chất tạo bởi hai..(1)..là..(2)…và..(3)..Nước tác dụng với một số..(4)..ở nhiệt độ thường và một số..(5)..tạo ra bazơ ; tác dụng với nhiều ..(6)..tạo ra axit.
2.Axit là hợp chất mà phân tử gồm có một hay nhiều ..(7)..liên kết với..(8)…
Phần B. Tự luận:
Câu III. Hoàn thành các phương trình hóa học sau:
![]()
Câu IV. Nhận biết các dung dịch sau đựng riêng biệt trong các lọ mất nhãn: NaOH; HCl; NaCl.
Câu V. Cho 5,6 g Canxi oxit tác dụng với nước thu được 200 ml dung dịch Canxi hiđroxit.
a) Viết phương trình hóa học cho phản ứng xảy ra?
b) Tính nồng độ mol của dung dịch thu được?
c) Tính thể tích khí CO2 (đktc) vừa đủ tác dụng với dung dịch Canxi hiđroxit trên để tạo thành muối trung hòa?
Cho biết: Na= 23; O= 16; H =1; C= 12; Fe =56; Cl= 35,5; Ca= 40.
Đáp án:
I.
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Đáp án | A | C | D | C | A | C | D | A |
II. 1.nguyên tố; 2. hiđrô; 3. oxi;4. kim loại; ;5. oxit bazơ;6. oxit axit;7. nguyên tử hiđrô;7; 8.gốc axit
III.
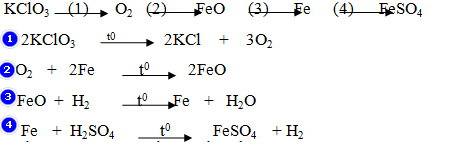
IV. -Lấy mỗi lọ một ít vào ống nghiệm và đánh dấu.
– Lần lượt thử bằng quỳ tím nếu:
+ Quỳ tím -> xanh -> dd NaOH
+ Quỳ tím -> đỏ -> dd HCl
+ Qùy tím không đổi màu là NaCl
V. a. Viết PTHH: CaO + H2O -> Ca(OH)2 (1)
b) n CaO = 0,1 mol
– Theo PTHH (1) ta có:
nCa(OH)2 = n CaO = 0,1 mol
=> CM Ca(OH)2 = 0,1/ 0,2 = 0,5 M
c) – PTHH: CO2 + Ca(OH)2 -> CaCO3 + H2O (2)
Theo (1) và (2) => n CO2 = nCa(OH )2=0,1 mol
=> V CO2(đktc) = 0,1. 22,4 = 2,24 (l)



![[Phòng GD & ĐT Hà Tĩnh] thi cuối năm học lớp 8 môn Toán: ho tam giác ABC cân tại A và M là trung điểm của BC. Lấy các điểm D, E theo thứ tự thuộc các cạnh AB, AC sao cho góc DME = góc B. Chứng minh ΔBDM đồng dạng với Δ CME](https://dethikiemtra.com/wp-content/uploads/2020/09/anh_1_INQG-100x75.jpg)


