
I. TRẮC NGHIỆM (6 ĐIỂM)
1. Nguyên tố R có Z = 35, vị trí của R trong bảng tuần hoàn là:
A. Chu kì 4, nhóm VIIA
B. Chu kì 4, nhóm VB
C. Chu kì 4, nhóm VA
D. Chu kì 4, nhóm VIIB
2. Chu kì là tập hợp các nguyên tố, mà nguyên tử của chúng có cùng?
A. Số electron ngoài cùng.
B. Số electron.
C. Số lớp electron.
D. Số electron hóa trị.
3. Trong bảng tuần hoàn các nguyên tố, số chu kì nhỏ và chu kì lớn là :
A. 4 và 4 B. 3 và 3
C. 3 và 4 D. 4 và 3
4. Nguyên tố X thuộc chu kì 3, nhóm IIA trong bảng tuần hoàn. Ở trạng thái cơ bản, số lớp electron của X là?
A. 1. B. 3.
C. 4. D. 2.
5. Hợp chất khí với hiđro của một nguyên tố là RH4. Oxit cao nhất của nó chứa 53,33% oxi về khối lượng. Nguyên tố đó là:
A. C B. Si
C. As D. Sb
6. Cho 4,4 g hỗn hợp 2 kim loại nhóm IIA thuộc hai chu kì liên tiếp với dung dịch HCl dư cho 3,36 lít khí H2(đktc). Hai kim loại là?
A. Ca, Sr B. Be, Mg
C. Mg, Ca D. Sr, Ba
7. Độ âm điện là:
A. Khả năng nhường electron của nguyên tử cho nguyên tử khác.
B. Khả năng tham gia phản ứng mạnh hay yếu.
C. Khả năng nhường protroncủa nguyên tử này cho nguyên tử khác.
D. Khả năng hút electron của nguyên tử trong phân tử.
8. Số oxi hóa của lưu huỳnh trong SO2 bằng?
A. +2. B. +6.
C. – 2. D. +4.
9. Cấu hình electron của nguyên tử nguyên tố X là 1s22s22p63s23p4. Số hiệu nguyên tử của X là?
Advertisements (Quảng cáo)
A. 14. B. 32.
C. 16. D. 8.
1.0: Nguyên tử khối trung bình của nguyên tố R là 79,91. R có 2 đồng vị. Biết 79R chiếm 54,5%, Nguyên tử khối của đồng vị còn lại có giá trị nào ?
A. 80 B. 82
C. 81 D. 85
1.1: Nguyên tố hóa học là?
A. những nguyên tử có cùng số khối.
B. những nguyên tử có cùng điện tích hạt nhân.
C. những nguyên tử có cùng số electron, proton, notron.
D. những nguyên tử có cùng số electron, notron.
1.2: Chất nào sau đây chứa liên kết ion? (Cho giá trị độ âm điện của các nguyên tố như sau: N = 3,04; C = 2,55; H = 2,20; K = 0,82 ; Cl = 3,16)
A. KCl. B. CH4.
C. NH3. D. N2.
1.3: Cho các hidroxit: Mg(OH)2, Al(OH)3, KOH, NaOH. Dãy nào được sắp xếp theo chiều tăng dần tính bazơ của chúng ?
A. KOH < NaOH < Al(OH)3< Mg(OH)2.
B. Al(OH)3<NaOH< KOH < Mg(OH)2.
C. Mg(OH)2<Al(OH)3<NaOH<KOH.
D. Al(OH)3< Mg(OH)2
1.4: Nguyên tử kali có 19 proton, 19 electron và 20 nơtron. Số khối của nguyên tử kali là
A. 20. B. 39.
Advertisements (Quảng cáo)
C. 38. D. 19.
1.5: Phân lớp 3p có số electron tối đa là ?
A. 10. B. 18.
C. 6. D. 2.
1.6: Nguyên tử của nguyên tố X có tổng số hạt là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là :
A. 27 B. 23
C. 28 D. 26
1.7: Dãy gồm các ion X+, Y– và nguyên tử Z đều có cấu hình electron 1s22s22p6 là:
A. Na+, F–, Ne.
B. Li+, F–, Ne.
C. Na+, Cl–, Ar.
D. K+, Cl–, Ar.
1.8: Cộng hoá trị của 1 nguyên tố là:
A. Số e tham gia liên kết của nguyên tử của nguyên tố đó.
B. Số thứ tự nhóm của nguyên tử.
C. Hoá trị cao nhất của nguyên tố.
D. Số liên kết của nguyên tử nguyên tố đó trong phân tử.
II. PHẦN TỰ LUẬN (4 ĐIỂM)
1. (1,5đ) Lập phương trình phản ứng oxi hoá- khử sau (cân bằng phương trình theo phương pháp thăng bằng electron), xác định chất oxi hoá, chất khử ?
a. Cu + H2SO4 đặc → CuSO4 + SO2 + H2O.
b. FexOy + HNO3→ Fe(NO3)3 + NnOm + H2O.
2. (2,5đ) Cho 7,04 gam hỗn hợp X gồm hai kim loại A, B cùng thuộc nhóm IIA và ở hai chu kỳ liên tiếp nhau tác dụng hết với dung dịch HCl 7,3% (lấy dư 10% so với lượng cần phản ứng) thu được dung dịch Y và 4,48 lít khí hiđro (đktc).
a. Xác định tên của 2 kim loại A, B.
b. Tính khối lượng dung dịch HCl ban đầu đã dùng.
c. Tính nồng độ % của các chất trong dung dịch Y.

|
1 |
2 |
3 |
4 |
5 |
|
A |
C |
C |
B |
B |
|
6 |
7 |
8 |
9 |
10 |
|
C |
D |
D |
C |
C |
|
11 |
12 |
13 |
14 |
15 |
|
B |
S |
D |
B |
C |
|
16 |
17 |
18 |
|
|
|
A |
A |
D |
||
II. PHẦN TỰ LUẬN (4 ĐIỂM)
1. a. Cu + 2H2SO4 đặc → CuSO4 + SO2 + 2H2O
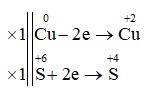
b. (5n-2m)FexOy + (18nx-6mx-2ny)HNO3→ (5nx-2mx)Fe(NO3)3 + (3x-2y)NnOm + (9nx-3mx-ny)H2O
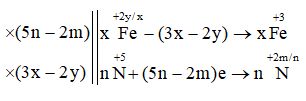
2.. a. Gọi công thức chung 2 kim loại là M.
M + 2HCl → MCl2 + H2
Ta thấy: nKL = nH2 = 4,48 : 22,4 = 0,2 mol
=> 24 (Mg) < Mtb = 7,04 : 0,2 = 35,2 < 40 (Ca)
Vậy 2 kim loại đó là Mg và Ca.
b. Theo bảo toàn nguyên tố H ta có: nHClpư = 2nH2 = 0,2.2 = 0,4 mol
Do lượng HCl đã dùng dư 10% so với lượng phản ứng nên lượng HCl dư là: nHCl dư = 0,4.10% = 0,04 mol
=> nHCl bđ = nHCl pư + nHCl dư = 0,4 + 0,04 = 0,44 mol
=> mHCl bđ = 0,44.36,5 = 16,06 gam
Khối lượng dung dịch HCl đã dùng là:
\({m_{{\text{dd}}\,HCl}} = \dfrac{{{m_{HCl}}}}{{C\% }}.100\% \)\(\,= \dfrac{{16,06.100\% }}{{7,3\% }} = 220(g)\)
c. Đặt số mol của Mg và Ca lần lượt là x và y (mol)
– Khối lượng hỗn hợp: 24x + 40y = 7,04 (1)
– Số mol hỗn hợp: x + y = 0,2 (2)
Giải (1) và (2) thu được x = 0,06 và y = 0,14
=> nMgCl2 = nMg = 0,06 mol
=> nCaCl2 = nCa = 0,14 mol
Khối lượng dung dịch sau phản ứng:
BTKL: m dd sau phản ứng = mKL + mdd HCl đã dùng – mH2 = 7,04 + 220 – 0,2.2 = 226,64 (g)
Dung dịch Y sau phản ứng gồm: MgCl2 (0,06 mol); CaCl2 (0,14 mol) và HCl dư (0,04 mol)
\(\eqalign{
& C{\% _{MgC{l_2}}} = {{0,06.95} \over {226,64}}.100\% = 2,515\% \cr
& C{\% _{CaC{l_2}}} = {{0,14.111} \over {226,64}}.100\% = 6,857\% \cr
& C{\% _{HCl}} = {{0,04.36,5} \over {226,64}}.100\% = 0,644\% \cr} \)





