
I. PHẦN TRẮC NGHIỆM (2,0đ)
1. Chất nào sau đây chứa liên kết ion?
A. N2. B. CH4.
C. KCl. D. NH3.
2.: Tổng số hạt mang điện trong nguyên tử X là 112. Số proton trong X là
A. 112. B. 56.
C. 48. D. 55.
3.: Nguyên tố X thuộc chu kì 3, nhóm IIA trong bảng tuần hoàn. Ở trạng thái cơ bản, số lớp electron của X là
A. 3. B. 1
C. 4. D. 2.
4.: Thứ tự tăng dần tính phi kim của các nguyên tố trong nhóm VIIA là
A. Br, F, I, Cl. B. F, Cl, Br, I
C. I, Br, F, Cl. D. I, Br, Cl, F.
5.: Cấu hình electron nào sau đây là của nguyên tố kim loại?
A. 1s22s22p63s23p6
B. 1s22s22p63s23p3
C. 1s22s22p63s23p1
D. 1s22s22p63s23p5.
6.: Số oxi hóa của lưu huỳnh trong SO2 bằng
Advertisements (Quảng cáo)
A. -2. B. +4.
C. +2. D. +6.
7.: Nguyên tử kali có 19 proton, 19 electron và 20 notron. Số khối của nguyên tử kali là
A. 20. B. 19.
C. 38. D. 39.
8.: Vị trí của flo (Z = 9) trong bảng tuần hoàn là
A. ô số 9, chu kì 2, nhóm VIIA.
B. ô số 9, chu kì 2, nhóm VA.
C. ô số 7, chu kì 3, nhóm VIIA.
D. ô số 7, chu kì 2, nhóm VA.
II. PHẦN TỰ LUẬN (8,0đ)
9.: (2,0đ) Hạt nhân nguyên tử X có 8 proton; nguyên tử Y có tổng số hạt mang điện bằng 52.
Advertisements (Quảng cáo)
a) Viết cấu hình electron của X, Y.
b) Viết cấu hình electron của Y2+; Y3+.
10: (2,0đ) Cân bằng các phản ứng sau bằng phương pháp thăng bằng electron
a) C + HNO3 → CO2 + NO2 + H2O
b) Cu2S + HNO3 → Cu(NO3)2 + H2SO4 + NO2 + H2O
11: (1,5đ) Trong tự nhiên đồng có hai đồng vị là và . Tính phần trăm số nguyên tử của mỗi đồng vị biết nguyên tử khối trung bình của đồng là 63,54 đvC.
12: (2,5đ) Nguyên tố X thuộc nhóm VIA trong bảng tuần hoàn. Phần trăm khối lượng của X trong oxit cao nhất là 40%.
a) Tìm nguyên tố X.
b) Gọi Y là hidroxit cao nhất của X. Viết công thức cấu tạo của Y (thỏa mãn qui tắc bát tử) và viết phương trình phản ứng của Y với K2CO3; BaCl2.

|
1 |
2 |
3 |
4 |
5 |
|
C |
B |
A |
D |
C |
|
6 |
7 |
8 |
|
|
|
B |
D |
A |
||
II. PHẦN TỰ LUẬN (8,0đ)
9. a) *Cấu hình e của X: ZX = số p = 8 => Cấu hình e của X: 1s22s22p4
*Cấu hình e của Y: Tổng hạt mang điện = 2ZY = 52 => ZY = 26
=> Cấu hình e của Y: 1s22s22p63s23p63d64s2
b) Cấu hình e của Y2+: 1s22s22p63s23p63d6
Cấu hình e của Y3+: 1s22s22p63s23p63d5
1.0:

1.1: Đặt x % và y % lần lượt là phần trăm của 2 đồng vị \({}_{29}^{63}Cu\) và \({}_{29}^{65}Cu\).
Theo đề bài ta có hệ phương trình sau:
\(\left\{ \matrix{
x + y = 100 \hfill \cr
{{63x + 65y} \over {100}} = 63,54 \hfill \cr} \right. \to \left\{ \matrix{
x = 73\% \hfill \cr
y = 27\% \hfill \cr} \right.\)
1.2: a) Hóa trị trong oxit cao nhất của một nguyên tố nhóm A bằng số thứ tự nhóm của nguyên tố đó.
X thuộc nhóm VIA nên có hóa trị VI trong oxit cao nhất => Công thức của oxit cao nhất là: XO3
\(\eqalign{
& \% {m_X} = {{{M_X}} \over {{M_X} + 16.3}}.100\% = 40\% \cr
& \to {M_X} = 32 \cr} \)
Vậy nguyên tố X là lưu huỳnh, kí hiệu: S
b) Công thức hiroxit cao nhất của S là: S(OH)6 khi bớt 2 H2O ta được H2SO4
– Công thức cấu tạo H2SO4:
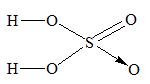
– PTHH:
H2SO4 + K2CO3 → K2SO4 + H2O + CO2
H2SO4 + BaCl2 → BaSO4 + 2HCl






