
A. TRẮC NGHIỆM: (6,0 điểm – 20 câu)
Chọn câu trả lời thí sinh cho là đúng nhất.
1. X là nguyên tố ở chu kì 3, nhóm IIIA và Y là nguyên tố ở chu kì 2, nhóm VIA. Công thức và loại liên kết của hợp chất tạo bởi X và Y có thể là:
A. X5Y2, liên kết cộng hóa trị.
B. X3Y2, liên kết ion.
C. X2Y3, liên kết ion.
D. X2Y5, liên kết cộng hóa trị.
2.: Công thức oxit bậc cao nhất của một nguyên tố là RO2. R thuộc nhóm
A. IVA. B. VIB.
C. VIA. D. IIIA.
3.: Cho 2 nguyên tố: X (Z = 14), Y (Z =17). Phát biểu nào sau đây đúng?
A. Tính phi kim: X > Y.
B. X, Y thuộc hai chu kì khác nhau trong bảng tuần hoàn.
C. Độ âm điện: X > Y.
D. Bán kính nguyên tử: X > Y.
4. Dãy nào sau đây chỉ gồm những phân tử không phân cực?
A. N2, CO2, Cl2, H2.
B. N2, Cl2, H2, HF.
C. N2, H2O, Cl2, O2.
D. Cl2, HCl, N2, F2.
5.: Trong anion X─ có tổng số hạt cơ bản là 53, số hạt mang điện chiếm 66,04%. Cấu hình electron của X─ là
A. 1s22s22p6.
B. 1s22s22p63s23p4.
C. 1s22s22p63s23p5.
D. 1s22s22p63s23p6.
6.: Số oxi hóa của C trong CO2, K2CO3, CO, CH4 lần lượt là
A. –4, + 4, +3, +4.
B. +4, +4, +2, +4.
C. +4, +4, +2, –4.
D. +4, –4, +3, +4.
7.: Cho các phát biểu sau:
(1) Nhóm IIIA là tập hợp những nguyên tố mà nguyên tử có 3e hóa trị.
(2) Trong phương trình hóa học: 2Fe + 3Cl2 2FeCl3. Fe là chất bị khử.
(3) Tất cả các nguyên tố nhóm IA đều là kim loại điển hình.
(4) Trong 1 nhóm A, độ âm điện của các nguyên tố tăng dần theo chiều tăng của điện tích hạt nhân.
(5) Số electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm B có tối đa bằng 2.
Số phát biểu không đúng là
A. 2. B. 3.
C. 5. D. 4.
8.: Nguyên tố hóa học là những nguyên tử có cùng
A. số nơtron và proton.
B. số khối.
C. số proton.
Advertisements (Quảng cáo)
D. số nơtron.
9.: Cho 1u = 1,66.10-27 kg. Nguyên tử khối của Neon là 20,179. Vậy khối lượng theo đơn vị kg của Neon là
A. 33,98.10-27kg.
B. 33,5.10-27kg.
C. 183,6.10-31kg.
D. 32,29.10-19kg.
10: Ion Y2+ có cấu hình electron: 1s22s22p63s23p6. Vị trí của Y trong bảng tuần hoàn là
A. chu kì 4, nhóm IA.
B. chu kì 3, nhóm IIA.
C. chu kì 4, nhóm IIA.
D. chu kì 3, nhóm VIA.
11: Nguyên tố Y tạo hợp chất khí với hiđro có công thức YH3. Trong hợp chất oxit cao nhất Y chiếm 25,92% về khối lượng. Xác định Y?
A. N (M= 14).
B. P (M = 31).
C. S (M = 32).
D. O (M = 16).
12: Nhận định nào sau đây không đúng?
A. Các đồng vị có cùng điện tích hạt nhân.
B. Các đồng vị có số electron khác nhau.
C. Các đồng vị có số khối khác nhau.
D. Các đồng vị có số nơtron khác nhau.
13: Mức năng lượng của các electron trên các phân lớp s, p, d thuộc cùng một lớp được xếp theo thứ tự là
A. p < s < d. B. s < p < d.
C. d < s < p. D. s < d < p.
14: Trong tự nhiên Li có 2 đồng vị là 6Li và 7Li và có nguyên tử khối trung bình là 6,94. Phần trăm khối lượng 7Li trong LiNO3 là (cho N = 14; O = 16)
A. 10, 067%. B. 9,362%.
C. 9,463%. D. 9,545%.
15: Trong tự nhiên brom có hai đồng vị là là và , nguyên tử khối trung bình của brom là 79,986. Nếu nguyên tử khối mỗi đồng vị có giá trị bằng số khối thì tỉ lệ % số nguyên tử đồng vị là
A. 49,3%. B. 50,7%.
Advertisements (Quảng cáo)
C. 46%. D. 54%.
16: Phản ứng nào sau đây là phản ứng oxi hóa-khử?
A. 2HgO → 2Hg + O2.
B. CaCO3 → CaO + CO2.
C. 2Al(OH)3 → Al2O3 + 3H2O.
D. 2NaHCO3 → Na2CO3 + CO2 + H2O.
17: Nguyên tử Na, Mg, F lần lượt có số hiệu nguyên tử là 11, 12, 9. Các ion Na+, Mg2+, F– khác nhau về
A. số electron lớp ngoài cùng.
B. số electron.
C. số lớp electron.
D. số proton.
18: Số nguyên tố thuộc chu kì 3 của bảng tuần hoàn là
A. 2. B. 32.
C. 18. D. 8.
19: Nguyên tử của nguyên tố nào sau đây luôn nhường 2e trong các phản ứng hóa học?
A. Mg (Z = 12).
B. Na (Z = 11).
C. Cl (Z = 17).
D. O (Z = 8).
20: Nguyên tố X nằm ở chu kì 3, nhóm VIA. X thuộc nguyên tố nào sau đây?
A. nguyên tố f.
B. nguyên tố s
C. nguyên tố p.
D. nguyên tố d.
B. TỰ LUẬN (4,0đ)
1. (1,0đ) Nguyên tử của nguyên tố X có tổng số hạt proton, nơtron, electron là 40. Số hạt mang điện trong hạt nhân nguyên tử X kém số hạt không mang điện là 1 hạt.
a. Xác định số hạt proton, electron, nơtron trong nguyên tử của nguyên tố X.
b. Viết cấu hình electron của ion tạo ra từ X.
2. (0,75đ). X+, Y─ có cấu hình electron giống cấu hình của Ar (Z = 18). Xác định vị trí của X, Y trong bảng tuần hoàn (giải thích vắn tắt).
3. (0,75đ). Cho 0,36 gam một kim loại R thuộc nhóm IIA tác dụng với oxi dư thu được 0,6 gam oxit. Tính nguyên tử khối của R ?
4. (1,50đ)
1. Cho ZH = 1, ZC = 6, ZO = 8, ZN = 7. Viết công thức cấu tạo của: NH3, H2CO3. Xác định hóa trị của N, C trong các phân tử đã cho.
2. Lập phương trình hóa học của phản ứng oxi hóa khử sau bằng phương pháp thăng bằng electron:
Cl2 + SO2 + H2O HCl + H2SO4

|
1 |
2 |
3 |
4 |
5 |
|
C |
A |
D |
A |
D |
|
6 |
7 |
8 |
9 |
10 |
|
C |
B |
C |
B |
C |
|
11 |
12 |
13 |
14 |
15 |
|
A |
B |
B |
D |
B |
|
16 |
17 |
18 |
19 |
20 |
|
A |
D |
D |
A |
C |
B. TỰ LUẬN
1. a. Gọi số p = số e = Z; số n = N
Tổng số hạt p, n, e là 40 nên ta có:
2Z + N = 40
Trong hạt nhân, số hạt mang điện kém số hạt không mang điện là 1 nên ta có: -Z + N = 1
→ Z = 13, N = 14
Vậy số p = số e = 13, số n = 14
b. Cấu hình e của nguyên tử X là: 1s22s22p63s23p1
Cấu hình electron của ion X3- là: 1s22s22p6
2. – Từ cấu hình của X+, Y– giống cấu hình của Ar suy ra cấu hình của
+ X: 1s22s22p63s23p64s1
+ Y: 1s22s22p63s23p5
Suy ra vị trí của X (ô thứ 19, chu kì 4, nhóm IA).
Suy ra vị trí của Y (ô thứ 17, chu kì 3, nhóm VIIA).
Giải thích:
+ Số thứ tự ô nguyên tố là số hiệu nguyên tử của nguyên tố Z (Z = số p = số e)
+ Chu kì = số lớp e
+ Số thứ tự nhóm = số e lớp ngoài cùng (đối với các nguyên tố s, p)
3. Gọi nguyên tử khối của R là R (đvC)
PTHH: 2R + O2 \( \to \)2RO
PT: R (g)………R+16 (g)
ĐB: 0,36(g)……0,6 (g)
=> 0,6R = 0,36(R + 16) => R = 24
Vậy nguyên tử khối của R là 24 đvC
4. 1.Cấu hình e của nguyên tử các nguyên tố:
H: 1s1
C: 1s22s22p2
O: 1s22s22p4
N: 1s22s22p3
Khi hình thành liên kết hóa học H có xu hướng góp chung 1e, C góp chung 4e, O góp chung 2e, N góp chung 3e để đạt được cấu hình bền vững của khí hiếm
– Công thức cấu tạo:
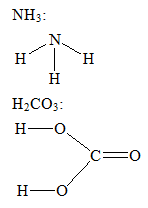
Trong các công thức cấu tạo trên N có hóa trị III, C có hóa trị IV
2. Cl2 + 2e → 2Cl–
S+4 – 2e → S+6
PTHH: Cl2 + SO2 + 2H2O \( \to \) 2HCl + H2SO4





