Đề kiểm tra Hóa Học lớp 10 có đáp án học kì 1 năm 2015. Thời gian làm bài 60 phút. Gồm 40 câu hỏi trắc nghiệm. Đáp án được tô màu đỏ.
Câu 1. Hầu hết nguyên tử được cấu tạo bởi bao nhiêu loại hạt cơ bản?
A. 1 B.2 C. 3 D. 4
Câu 2. Nguyên tố hoá học là những nguyên tử có cùng
A. số proton
B.số khối.
C.số nơtron.
D.số nơtron và số proton.
Câu 3. Số proton và số nơtron có trong một nguyên tử nhôm () lần lượt là
A. 13 và 14.
B.13 và 15.
C.12 và 14.
D.13 và 13.
Câu 4. Số electron tối đa của lớp M là?
A. 3
B.9 C. 18 D. 32
Câu 5. Phân lớp p chứa tối đa
A. 2 electron.
B.6 electron.
C.10 electron.
D.14 electron.
Câu 6. Sự chuyển động của electron trong nguyên tử có tính chất
A. theo những quỹ đạo tròn.
B.theo những quỹ đạo hình bầu dục.
C.không theo quỹ đạo xác định.
D.theo những quỹ đạo xác định những quỹ đạo có hình dạng bất kì.
Câu 7. Cho những nguyên tử của các nguyên tố sau:
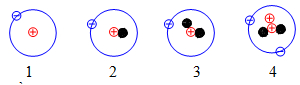
Đồng vị có tên triti là?
A. 1 và 2
B.2
C.2 và 3
D.3
Câu 8. Cấu hình electron nào sau đây là của phi kim?
A. 1s22s1.
B.1s22s22p63s2.
C.1s22s22p63s23p63d104s2.
D.1s22s22p63s23p5.
Câu 9. Các nguyên tố xếp ở chu kì 5 có số lớp electron trong nguyên tử là:
A. 3
B.5
C.6
D.7
Câu 10. Trong Bảng tuần hoàn các nguyên tố, số chu kì nhỏ và số chu kì lớn là:
A. 3 và 3
B.3 và 4
C.4 và 3
D.4 và 4
Câu 11. Số nguyên tố trong chu kì 3 và 5 là :
A. 8 và 8
B.8 và 18
C.18 và 8
D.18 và 1
Câu 12. Nhóm I A gồm các nguyên tố Li-Na-K-Rb-Cs có tên gọi khác là gì?
A. kim loại kiềm
B.halogen.
C.khí hiếm.
D.kim loại kiềm thổ.
Câu 13. Nhóm A bao gồm các nguyên tố:
A. s và p
B.s và d
C.d và f
D.p và f
Advertisements (Quảng cáo)
Câu 14. Nguyên tố X có cấu hình electron 1s22s22p63s23p64s2, vị trí của X trong bảng tuần hoàn là:
A. ở ô thứ 20, chu kì 4, nhóm IIB.
B.ở ô thứ 20, chu kì 4, nhóm VIIIA.
C.ở ô thứ 4, chu kì 20, nhóm IIA.
D.ở ô thứ 20, chu kì 4, nhóm IIA.
Câu 15. Xét trong một nhóm A theo chiều tăng điện tích hạt nhân thì tính kim loại biến đổi như thế nào?
A. tăng và giảm
B.giảm dần.
C.giảm và tăng.
D.tăng dần.
Câu 16. Dãy các nguyên tố nào sau đây được xếp theo chiều tăng dần tính kim loại?
A. K, Na, Mg, Al B. Mg, Na, K, Na
C.Al, Mg, Na, K D. Na, K, Mg, Al
Câu 17. Hai nguyên tố X, Y đứng kế nhau trong cùng một chu kì của bảng tuần hoàn có tổng số đơn vị điện tích hạt nhân là 25. Hai nguyên tố A, B là?
A. Na, Mg
B.Mg, Al C. N, O D. P, S
Câu 18. Dãy gồm các chất trong phân tử chỉ có liên kết cộng hoá trị phân cực là:
A. HCl, O3, H2S.
B.O2, H2O, NH3.
C.HF, Cl2, H2O.
D.H2O, HF, H2S.
Câu 19. Liên kết ion tạo thành giữa hai nguyên tử
A. kim loại điển hình.
B.phi kim điển hình.
C.kim loại và phi kim.
D.kim loại điển hình và phi kim điển hình.
Câu 20. Hầu hết các hợp chất ion
A. có nhiệt độ nóng chảy và nhiệt độ sôi cao.
B.dễ hòa tan trong các dung môi hữu cơ.
C.ở trạng thái nóng chảy không dẫn điện.
D.tan trong nước thành dung dịch không điện li.
Câu 21. Phát biểu nào sau đây sai:
Advertisements (Quảng cáo)
A. Điện hóa trị có trong hợp chất ion.
B.Điện hóa trị bằng số cặp electron dùng chung.
C.Cộng hóa trị có trong hợp chất cộng hóa trị.
D.Cộng hóa trị bằng số cặp electron dùng chung.
Câu 22. Chất khử là chất
A. nhận electron và có số oxi hoá giảm sau phản ứng.
B.nhận electron và có số oxi hoá tăng sau phản ứng.
C.nhường electron và có số oxi hoá giảm sau phản ứng.
D.nhường electron và có số oxi hoá tăng sau phản ứng.
Câu 23. Chất oxi hoá là chất
A. cho electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
B.cho electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
C.nhận electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
D.nhận electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Câu 24. Trong phản ứng MnO2 + 4HCl ® MnCl2 + Cl2 + 2H2O, vai trò của MnO2 là chất
A. oxi hóa. B. khử. C. tạo môi trường. D. khử và môi trường.
Câu 25. Phản ứng nhiệt phân muối thuộc phản ứng
A. oxi hóa- khử. B. không oxi hóa-khử.
C.oxi hóa- khử hoặc không. D. thuận nghịch.
Câu 26. Cho phương trình phản ứng: HCl + KMnO4 → KCl + MnCl2 + Cl2 + H2O
Sau khi cân bằng tổng hệ số của các chất tham gia phản ứng là là
A. 17
B.35
C.16
D.18
Câu 27. Cho các phát biểu sau:
a) Điện hóa trị của một nguyên tố là hóa trị của nguyên tử nguyên tố đó trong hợp chất ion.
b) Cộng hóa trị của một nguyên tố là hóa trị của nguyên tử nguyên tố đó trong hợp chất cộng hóa trị.
c) Điện hóa trị của một nguyên tố bằng điện tích ion của nguyên tử nguyên tố đó trong phân tử.
d) Cộng hóa trị của một nguyên tố bằng số liên kết của nguyên tử nguyên tố đó với các nguyên tử khác trong phân tử.
e) Số oxi hóa của đơn chất luôn bằng không trừ chất rắn.
f) Số oxi hóa của oxi trong hợp chất luôn là -2.
Số pháp biểu đúng là:
A. 3
B.4
C.5
D.6
Câu 28. Anion X– và cation Y2+ đều có cấu hình electron lớp ngoài cùng là 3s23p6. Vị trí của các nguyên tố trong bảng tuần hoàn các nguyên tố hóa học là:
A. X có số thứ tự 17, chu kỳ 4, nhóm VIIA (phân nhóm chính nhóm VII); Y có số thứ tự 20, chu kỳ 4, nhóm IIA (phân nhóm chính nhóm II).
B.X có số thứ tự 18, chu kỳ 3, nhóm VIA (phân nhóm chính nhóm VI); Y có số thứ tự 20, chu kỳ 4, nhóm IIA (phân nhóm chính nhóm II).
C.X có số thứ tự 17, chu kỳ 3, nhóm VIIA (phân nhóm chính nhóm VII); Y có số thứ tự 20, chu kỳ 4, nhóm IIA (phân nhóm chính nhóm II).
D.X có số thứ tự 18, chu kỳ 3, nhóm VIIA (phân nhóm chính nhóm VII); Y có số thứ tự 20, chu kỳ 3, nhóm IIA (phân nhóm chính nhóm II).
Câu 29. Đồng có 2 đồng vị 63Cu (69,1%) và 65 Nguyên tử khối trung bình của đồng là:
A. 64, 000(u)
B.63,542(u)
C.64,382(u)
D.63,618(u)
Câu 30. Công thức phân tử của hợp chất khí tạo bởi nguyên tố R và hiđro là RH3. Trong oxit mà R có hoá trị cao nhất thì oxi chiếm 74,07% về khối lượng. Nguyên tố R là (S=32; N= 14; As= 75, P= 31)
A. S.
B.As.
C.N.
D.P.
Câu 31. Cho 6,4 gam hỗn hợp hai kim loại A và B (nhóm IIA, thuộc hai chu kì liên tiếp) tác dụng với dung dịch HCl dư, thu được 4,48 lít khí H2 (đktc). Hai kim loạ A, B là: (Be=9, Mg=24, Ca=40, Sr=88, Ba=137)
A. Be, Mg
B.Ca, Sr
C.Sr, Ra
D.Mg, Ca
Câu 32. Trong tự nhiên oxi có 3 đồng vị bền:; ; còn nguyên tố cacbon có 2 đồng vị bền: ; . Số lượng phân tử CO tạo thành từ các đồng vị trên là
A. 6
B.12
C.9
D.18
Câu 33. Trong tự nhiên đồng có hai đồng vị và trong đó đồng vị chiếm 27% về số nguyên tử. Phần trăm khối lượng của tronng Cu2O gần giá trị nào dưới đây?
A. 88,5%
B.32,5%
C.63,5%
D.64,5%
Câu 34. Khối lượng riêng của canxi kim loại là 1,55 g/cm3. Giả thiết rằng, trong tinh thể canxi các nguyên tử là những hình cầu chiếm 74% thể tích tinh thể, phần còn lại là khe rỗng. Bán kính nguyên tử canxi tính theo lí thuyết gần giá trị nào sao đây?
A. 0,16 nm.
B.0,17 nm.
C.0,18 nm.
D.0,19 nm.
Câu 35. Hoà tan hoàn toàn 2,81 gam hỗn hợp gồm Fe2O3, MgO, ZnO trong 500 ml axit H2SO4 0,1M (vừa đủ). Sau phản ứng, hỗn hợp muối sunfat khan thu được khi cô cạn dung dịch có khối lượng là (cho H = 1, O = 16, Mg = 24, S = 32, Fe = 56, Zn = 65)
A. 6,81 gam.
B.4,81 gam.
C.3,81 gam.
D.5,81 gam.
Câu 36. Khi cho 100ml dung dịch KOH 1M vào 100ml dung dịch HCl thu được dung dịch có chứa 6,525 gam chất tan. Nồng độ mol (hoặc mol/l) của HCl trong dung dịch đã dùng là
A. 0,75M.
B.1M.
C.0,25M.
D.0,5M.
Câu 37. Cho 0,85 gam hai kim loại thuộc hai chu kỳ kế tiếp trong nhóm IA vào cốc chứa 49,18 gam H2O thu được dung dịch A và khí
B.Để trung hòa dung dịch A cần 30 ml dung dịch HCl 1M. Nồng độ % của các chất chất tan có khối lượng phân tử lớn nhất trong dung dịch A là:
A. 20%
B.11,2%
C.1,12%
D.1,6%
Câu 38. Hoà tan Zn và ZnO vào HNO3 loãng dư. Kết thúc thí nghiệm thu được 8g NH4NO3 (không có khí thoát ra) và 113,4 gam Zn(NO3)2. Phần trăm số mol của Zn trong hỗn hợp là
A. 66,67%
B.33,33%
C.16,66%
D.93,34%
Câu 39. Hòa tan hoàn toàn 12 gam hỗn hợp Fe, Cu (tỉ lệ mol 1:1) bằng axit HNO3, thu được V lít (ở đktc) hỗn hợp khí X (gồm NO và NO2) và dung dịch Y (chỉ chứa hai muối và axit dư). Tỉ khối của X đối với H2 bằng 19. Giá trị của V là (cho H = 1, N = 14, O = 16, Fe = 56, Cu = 64)
A. 2,24.
B.4,48.
C.5,60.
D.3,36.
Câu 40. Hoà tan hoàn toàn hỗn hợp X gồm Fe và Mg bằng một lượng vừa đủ dung dịch HCl 20%, thu được dung dịch Y. Nồng độ của FeCl2 trong dung dịch Y là 15,76%. Nồng độ phần trăm của MgCl2 trong dung dịch Y là
A. 24,24%.
B.11,79%.
C.28,21%.
D.15,76%.