
1. Cho dung dịch axit CH3COOH 0,1M.
Biết \({K_{C{H_3}COOH}} = 1,{75.10^{ – 5}};\) \(\lg {K_{C{H_3}C{\rm{OO}}H}} = – 4,757\)
– Tính nồng độ của các ion trong dung dịch và tính pH.
– Tính độ điện li \(\alpha \) của axit trên.
2. Cho các oxit sau: \(S{O_3},C{l_2}{O_7},Pb{O_2},CaO\). Hãy sắp xếp theo chiều tăng dần tính axit của các oxit trên.
3. Cho a mol CO2 vào dung dịch chứa 2a mol KOH thu được dung dịch X. Cho X dư vào dung dịch Al(NO3)3 thì sẽ có hiện tượng gì?

1. Phương trình điện li:
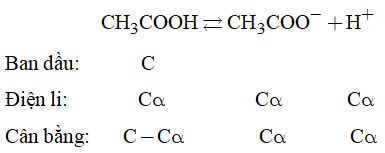
Gọi \(\alpha \) là độ điện li của axit
Hằng số cân bằng Ka:
Advertisements (Quảng cáo)
\({K_a} = \dfrac{{\left[ {{H^ + }} \right]\left[ {C{H_3}{\rm{CO}}{{\rm{O}}^ – }} \right]}}{{\left[ {C{H_3}{\rm{COOH}}} \right]}}\)\(\, = \dfrac{{{{\left[ {{H^ + }} \right]}^2}}}{{\left[ {C{H_3}{\rm{COOH}}} \right]}}\)
Cách 1:
\({K_a} = \dfrac{{\left[ {{H^ + }} \right]\left[ {C{H_3}CO{O^ – }} \right]}}{{\left[ {C{H_3}{\rm{COOH}}} \right]}} \)\(\,= \dfrac{{C\alpha .C\alpha }}{{C – C\alpha }} = \dfrac{{{{\left( {C\alpha } \right)}^2}}}{{C\left( {1 – \alpha } \right)}} = \dfrac{{C{\alpha ^2}}}{{1 – \alpha }}\)
Vì CH3COOH là axit yếu nên \(\alpha \) nhỏ, giả sử \(1 – \alpha \approx 1\)
\(\begin{array}{l} \Rightarrow {K_a} = C{\alpha ^2} \Rightarrow C\alpha = \sqrt {C{K_a}} \\\left[ {{H^ + }} \right] = \sqrt {C{K_a}} \\\;\;\;\;\;\;\;\;\;= \sqrt {0,1 \times 1,75 \times {{10}^{ – 5}}} \\ \;\;\;\;\;\;\;\;\; = \sqrt {1,{{75.10}^{ – 3}}}\\ \;\;\;\;\;\;\;\;\;= 1,{323.10^{ – 3}}\left( {mol/l} \right)\\ \Rightarrow pH = – \lg \sqrt {C{K_a}} \\ \;\;\;\;\;\;\;\;\;\;\;= \dfrac{1}{2}\left( { – \lg {K_a} – \lg C} \right) \\ \;\;\;\;\;\;\;\;\;\;\;= \dfrac{1}{2}\left( {4,757 + 1} \right) = 2,88\end{array}\)
\(\begin{array}{l}\text{Độ điện li }\alpha :{\rm{ C}}\alpha = \sqrt {C{K_a}} \\ \Rightarrow \alpha = \dfrac{{\sqrt {C{K_a}} }}{C}\\ \;\;\;\;\;\;\;\;= \dfrac{{\sqrt {0,1 \times 1,{{755.10}^{ – 5}}} }}{{0,1}}\\\;\;\;\;\;\;\;\; = \sqrt {1,{{75.10}^{ – 4}}} \\ \;\;\;\;\;\;\;\;= 1,{32.10^{ – 2}}\;hay\;1,32\% \end{array}\)
Cách 2: Gọi:
\(\begin{array}{l}\left[ {{H^ + }} \right] = \left[ {C{H_3}CO{O^ – }} \right] = x;\\ \left[ {C{H_3}COOH} \right] = C – x\\ \Rightarrow {K_a} = \dfrac{{\left[ {{H^ + }} \right]\left[ {C{H_3}CO{O^ – }} \right]}}{{\left[ {C{H_3}COOH} \right]}} = \dfrac{{{x^2}}}{{C – x}}\\ \Rightarrow {x^2} = {K_a}\left( {C – x} \right)\\ \Leftrightarrow {x^2} + {K_a}x – {K_a}.C = 0\\ \Leftrightarrow {x^2} + 1,{75.10^{ – 5}}x – 1,{75.10^{ – 6}} = 0\left( 1 \right)\end{array}\)
Advertisements (Quảng cáo)
Giải phương trình (1) và loại nghiệm âm, ta có:
\(x = 1,{3.10^{ – 3}} = \left[ {{H^ + }} \right] \)
\(\Rightarrow pH = – \lg 1,{3.10^{ – 3}} \approx 2,88.\)
2. Tính phi kim của các nguyên tố được sắp xếp theo chiều tăng dần:
Ca < Pb < S < Cl
\( \Rightarrow \) Tính axit cũng tăng dần: CaO < PbO2 < SO3 < Cl2O7.
3.: Phản ứng:
\(\begin{array}{l}C{O_2} + 2KOH \to {K_2}C{O_3} + {H_2}O\\{\rm{a}} \to \;\;\;\;{\rm{2a }}\left( {mol} \right)\end{array}\)
Dung dịch X chứa K2CO3 nên có các quá trình sau:
\(\begin{array}{l}{K_2}C{O_3} \to 2{K^ + } + CO_3^{2 – }\\Al{\left( {N{O_3}} \right)_3} \to A{l^{3 + }} + 3NO_3^ – \\CO_3^{2 – } + HOH \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} HCO_3^ – + O{H^ – }\\HCO_3^ – + HOH \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} C{O_2} \uparrow + {H_2}O + O{H^ – }\\A{l^{3 + }} + 3O{H^ – } \to Al{\left( {OH} \right)_3} \downarrow \end{array}\)
(keo trắng)
Vậy phản ứng xảy ra là:
\(2Al{\left( {N{O_3}} \right)_3} + 3{K_2}C{O_3} + 3{H_2}O \to \)\(\;2Al{\left( {OH} \right)_3} \downarrow + 3C{O_2} \uparrow + 6KN{O_3}\)

