Bài 1: Hãy ghép cấu hình electron ở trạng thái cơ bản với nguyên tử thích hợp.
|
Cấu hình electron A. \(\left[ {Ne} \right]3{s^2}3{p^4}\) B. \(1{s^2}2{s^2}2{p^4}\) C. \(\left[ {Kr} \right]4{d^{10}}5{s^2}5{p^4}\) D. \(\left[ {Ar} \right]3{d^{10}}4{s^2}4{p^4}\) |
Nguyên tử a. O b. Te c. Se d. S |
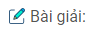
A – d B – a
C – b D – c.
Bài 2: Tính chất nào sau đây không đúng đối với nhóm oxi (nhóm VIA) ?
Từ nguyên tố oxi đến nguyên tố telu:
A. Độ âm điện của nguyên tử giảm dần.
B. Bán kính nguyên tử tăng dần.
C. Tính bền của hợp chất với hiđro tăng dần.
D. Tính axit của hợp chất hiđroxit giảm dần.
Advertisements (Quảng cáo)
Chọn C.
Bài 3: Hãy giải thích vì sao:
a) Trong hợp chất OF2, nguyên tố oxi có số oxi hóa +2 ?
b) Trong hợp chất SO2, nguyên tố lưu huỳnh có số oxi hóa +4 ?
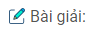
a) Trong hợp chất OF2: oxi hóa có 2 liên kết cộng hóa trị với 2 nguyên tử F, F có độ âm điện 3,98 lớn hơn độ âm điện của oxi 3,44 vì vậy số oxi hóa của O là +2.
Advertisements (Quảng cáo)
b) Trong hợp chất SO2: lưu huỳnh có 4 liên kết cộng hóa trị với 2 nguyên tử O, vì lưu huỳnh có độ âm điện 2,58 nhỏ hơn độ âm điện của oxi hóa của oxi 3,44. Vì vậy số oxi hóa là +4.
Bài 4: Hãy giải thích vì sao:
a) Trong hợp chất cộng hóa trị với những nguyên tố có độ âm điện nhỏ hơn, các nguyên tố trong nhóm oxi có số oxi hóa là -2?
b) Trong hợp chất cộng hóa trị với những nguyên tố có độ âm điện lớn hơn, các nguyên tố trong nhóm oxi (S, Se, Te) có số oxi hóa là +4 và cực đại là +6 ?
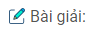
a) Trong hợp chất cộng hóa trị của các nguyên tố nhóm oxi với những nguyên tố có độ âm điện nhỏ hơn, cặp electron chung lệch về phía các nguyên tố có độ âm điện lớn hơn, theo quy ước sẽ là nguyên tử mang một phần điện tích âm vì vậy có số oxi hóa âm. (-2)
b) Trong hợp chất cộng hóa trị của các nguyên tố S, Se, Te với những nguyên tố có độ âm điện lớn hơn, cặp electron chung bị lệch về phía nguyên tố có độ âm điện lớn hơn vì vậy S, Se, Te có số oxi hóa dương. Vì S, Se, Te có phân lớp d, ở trạng thái kích thích S, Se, Te có thể có 4 hoặc 6 electron độc thân tham gia liên kết nên S, Se, Te có số oxi hóa +4, +6.
Bài 5: Có những cấu hình electron sau đây:
\(\eqalign{ & a)\,\,1{s^2}2{s^2}2{p^6}3{s^2}3{p^4} \cr & b)\,\,1{s^2}2{s^2}2{p^6}3{s^2}3{p^3}3{d^1} \cr & c)\,\,1{s^2}2{s^2}2{p^6}3{s^1}3{p^3}3{d^2} \cr} \)
Hãy cho biết:
– Cấu hình electron viết ở trên là nguyên tử nguyên tố nào?
– Cấu hình electron nào ở trạng thái cơ bản ? Cấu hình electron nào ở trạng thái kích thích ?
– Từ cấu hình electron suy ra tổng số electron ở cả 3 cấu hình a, b, c đều bằng 16. Vậy Z bằng 16, nguyên tố là S.
– Cấu hình electron a) trạng thái cơ bản, cấu hình electron b, c ở trạng thái kích thích.

