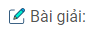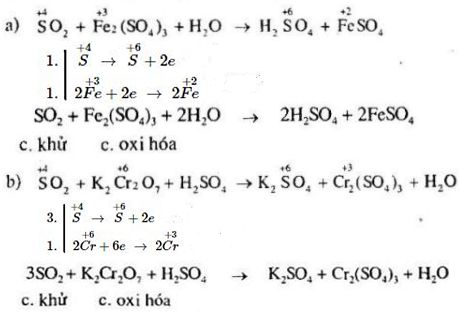Bài 1: Lưu huỳnh đioxit có thể tham gia những phản ứng sau :
\(\eqalign{ & S{O_2} + B{r_2} + 2{H_2}O\,\,\, \to \,\,2HBr + {H_2}S{O_4}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\left( 1 \right) \cr & S{O_2} + 2{H_2}S\,\, \to \,\,3S + 2{H_2}O\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\left( 2 \right) \cr} \)
Câu nào sau đây diễn tả không đúng tính chất của các chất trong những phản ứng trên ?
A. Phản ứng (1) : SO2 là chất khử, Br2 là chất oxi hóa.
B. Phản ứng (2) : SO2 là chất oxi hóa, H2S là chất khử.
C. Phản ứng (2) : SO2 vừa là chất khử, vừa là chất oxi hóa.
D. Phản ứng (1) : Br2 là chất oxi hóa, phản ứng (2) : H2S là chất khử.
Chọn C.
Bài 2: Hãy ghép cặp chất và tính chất của chất sao cho phù hợp :
|
Chất A. S B. SO2 C. H2S D. H2SO4 |
Tính chất của chất a) Có tính oxi hóa b) có tính khử c) chất rắn có tính oxi hóa và tính khử d) không có tính oxi hóa và tính khử. e) chất khí có tính oxi hóa và tính khử |
A – c;
B – e;
Advertisements (Quảng cáo)
C – b;
D – a.
Bài 3: Hãy chọn hệ số đúng của các chất oxi hóa và của chất khử trong phản ứng sau :
\(KMn{O_4} + {H_2}{O_2} + {H_2}S{O_4}\,\, \to \,\,MnS{O_4} + {O_2} \)
\(+{K_2}S{O_4} + {H_2}O\)
A. 3 và 5
B. 5 và 2
C. 2 và 5
Advertisements (Quảng cáo)
D. 5 và 3.
Chọn C.
\(K\mathop {Mn}\limits^{ + 7} {O_4} + {H_2}\mathop {{O_2}}\limits^{ – 1} + {H_2}S{O_4}\,\, \to \,\,\mathop {Mn}\limits^{ + 2} S{O_4} + \mathop {{O_2}}\limits^0 \uparrow \)
\(+ {K_2}S{O_4} + {H_2}O\)
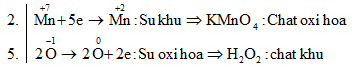
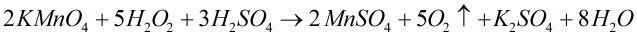
Bài 4: Hãy lập bảng so sánh những tính chất giống nhau, khác nhau giữa hai hợp chất của lưu huỳnh là hiđro sunfua và lưu huỳnh đioxit về :
a) Tính chất vật lí.
b) Tính chất hóa học, giải thích và chứng minh bằng phương trình hóa học.
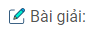
So sánh những tính chất vật lí của H2S và SO2:
b) Bảng so sánh tính chất hóa học của H2S và SO2

Bài 5: Hãy lập những phương trình hóa học sau và cho biết vai trò của các chất tham gia phản ứng:
\(\eqalign{ & a)\,\,S{O_2} + F{e_2}{\left( {S{O_4}} \right)_3} + {H_2}O\,\, \to \,\,{H_2}S{O_4} + FeS{O_4} \cr & b)\,\,S{O_2} + {K_2}C{r_2}{O_7} + {H_2}S{O_4}\,\, \to \,\,{K_2}S{O_4} + C{r_2}{\left( {S{O_4}} \right)_3} + {H_2}O \cr & c)\,\,{H_2}S + C{l_2}\,\, \to \,\,S + HCl \cr & d)\,\,{H_2}S + S{O_2}\,\, \to \,\,S + {H_2}O \cr & e)\,\,S{O_2} + B{r_2} + {H_2}O\,\, \to \,\,HBr + {H_2}S{O_4} \cr} \)