Bài 1: Chất nào sau đây vừa có tính oxi hóa, vừa có tính khử?
A. O3;
B. H2SO4;
C. H2S;
D. H2O2.
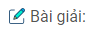
Chọn D.
Bài 2: Câu nào sau đây không diễn tả đúng tính chất của các chất?
A. O2 và O3 cùng có tính oxi hóa, nhưng O3 có tính oxi hóa mạnh hơn.
B. H2O và H2O2 cùng có tính oxi hóa, nhưng H2O có tính oxi hóa yếu hơn.
C. H2SO3 và H2SO4 cùng có tính oxi hóa, nhưng H2SO4 có tính oxi hóa mạnh hơn.
D. H2S và H2SO4 cùng có tính oxi hóa, nhưng H2S có tính oxi hóa yếu hơn.
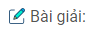
Chọn D.
Bài 3: Axit sunfuric tham gia phản ứng với các chất, tùy thuộc vào điều kiện của phản ứng (nồng độ của axit, nhiệt độ của phản ứng, mức độ hoạt động của chất khử) có những phản ứng hóa học:
Advertisements (Quảng cáo)
\(\eqalign{ & {H_2}S{O_4} + HI\,\, \to \,\,{I_2} + {H_2}S + {H_2}O \cr & {H_2}S{O_4} + HBr\,\, \to \,\,B{r_2} + S{O_2} + {H_2}O \cr & {H_2}S{O_4} + Fe\,\, \to \,\,F{e_2}{\left( {S{O_4}} \right)_3} + S{O_2} + {H_2}O \cr & {H_2}S{O_4} + Zn\,\, \to \,\,ZnS{O_4} + S{O_2} + {H_2}O \cr & {H_2}S{O_4} + Zn\,\, \to \,\,ZnS{O_4} + S + {H_2}O \cr & {H_2}S{O_4} + Zn\,\, \to \,\,ZnS{O_4} + {H_2}S + {H_2}O \cr} \)
a) Hãy cho biết số oxi hóa của những nguyên tố nào thay đổi và thay đổi như thế nào?
b) lập phương trình hóa học của những phản ứng trên.
c) Cho biết vai trò của những chất tham gia phản ứng oxi hóa – khử trên.
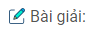
a, b) Sự thay đổi số oxi hóa và lâp phương trình phản ứng:
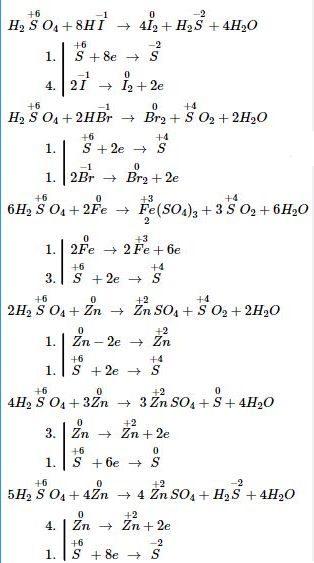
c) Trong những phản ứng trên: H2SO4 là chất oxi hóa còn HI, HBr, Fe, Zn là các chất khử.
Bài 4: Những dụng cụ bằng bạc hoặc đồng sẽ chuyển thành màu đen trong không khí hay trong nước có chứa hiđro sunfua, là do chúng bị phủ bằng một lớp muối sunfua kim loại có màu đen theo các phản ứng sau:
Advertisements (Quảng cáo)
\(\eqalign{ & Ag + {H_2}S + {O_2}\,\, \to \,\,A{g_2}S + {H_2}O \cr & Cu + {H_2}S + {O_2}\,\, \to \,\,CuS + {H_2}O \cr} \)
a) Hãy xác định số oxi hóa của những nguyên tố tham gia phản ứng oxi hóa – khử.
b) Lập phương trình hóa học của những phản ứng trên.
c) Cho biết vai trò của những chất tham gia phản ứng oxi hóa – khử.
a) Số oxi hóa của nguyên tố tham gia phản ứng oxi hóa – khử:
\(\mathop {Ag}\limits^0 + {H_2}\mathop S\limits^{ – 1} + \mathop {{O_2}}\limits^0 \,\, \to \,\,\mathop {A{g_2}}\limits^{ + 1} \mathop S\limits^{ – 2} + {H_2}\mathop O\limits^{ – 2} \)
Số oxi hóa của Ag tăng từ 0 đến +1.
Số oxi hóa của oxi giảm từ 0 xuống -2.
\(\mathop {Cu}\limits^0 + {H_2}\mathop S\limits^{ – 1} + \mathop {{O_2}}\limits^0 \,\, \to \,\,\mathop {Cu}\limits^{ + 2} \mathop S\limits^{ – 2} + {H_2}\mathop O\limits^{ – 2} \)
Số oxi hóa của Cu tăng từ 0 đến +2.
Số oxi hóa của O giảm từ 0 xuống -2.
b) Cân bằng phản ứng oxi hóa – khử.
\(\eqalign{ & 4Ag + 2{H_2}S + {O_2}\,\, \to \,\,2A{g_2}S + 2{H_2}O \cr & 2Cu + 2{H_2}S + {O_2}\,\,\, \to \,\,2CuS + 2{H_2}O \cr} \)
c) Trong các phản ứng trên: chất khử là Ag, Cu còn chất oxi hóa là oxi.
Bài 5: Nếu đốt Mg trong không khí rồi đưa vào bình đựng khí lưu huỳnh đioxit, nhận thấy có hai chất bột được sinh ra: bột A màu trắng và bột B màu vàng. Bột B không tác dụng với dung dịch axit sunfuric loãng, nhưng cháy được trong không khí, sinh ra khí C làm mất màu dung dịch kali penmanganat.
a) Hãy cho biết tên các chất A, B, C và giải thích.
b) Viết phương trình hóa học của các phản ứng đã xảy ra.
a) Tên các chất A, B, C: Chất A: MgO, chất B: S, chất C: SO2.
b) Các phản ứng:
\(\eqalign{ & 2Mg\left( r \right) + {O_2}\left( k \right)\,\,\buildrel {{t^0}} \over \longrightarrow 2MgO\left( r \right) \cr & 2Mg\left( r \right) + S{O_2}\left( k \right)\buildrel {{t^0}} \over \longrightarrow 2MgO\left( r \right) + S\left( r \right) \cr & S\left( r \right) + {O_2}\left( k \right)\buildrel {{t^0}} \over \longrightarrow S{O_2}\left( k \right) \cr} \)

