Bài 6: Cho các dung dịch không màu của các chất sau: NaCl, K2CO3, Na2SO4, HCl, Ba(NO3)2. Hãy phân biệt các dung dịch đã cho bằng phương pháp hóa học mà không dùng thêm hóa chất nào khác làm thuốc thử. Viết các phương trình hóa học, nếu có.
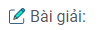
Lẫy mỗi dung dịch một ít rồi chia ra 5 ống nghiệm có đánh số. Cho lần lượt từng dung dịch vào các dung dịch còn lại, hiện tượng thí nghiệm được ghi trong bảng sau:
Nhận xét:
Ở dung dịch nào không có hiện tượng gì thì đó là NaCl.
Ở dung dịch nào có một trường hợp thoát khí và một trường hợp kết tủa là K2CO3
\(\eqalign{ & {K_2}C{O_3} + 2HCl\,\, \to \,\,2KCl + {H_2}O + C{O_2} \uparrow \,\,\,\left( 1 \right) \cr & {K_2}C{O_3} + Ba{\left( {N{O_3}} \right)_2}\,\, \to \,\,2KN{O_3} + BaC{O_3} \downarrow \,\,\left( 2 \right) \cr} \)
Ở dung dịch nào có một trường hợp kết tủa là dung dich Na2SO4:
\(N{a_2}S{O_4} + Ba{\left( {N{O_3}} \right)_2} \to \,\,2NaN{O_3} + BaS{O_4} \downarrow \left( 3 \right)\)
Ở dung dịch nào có một trường hợp khí thoát ra là dung dịch HCl: Phương trình (1).
Ở dung dịch nào có hai trường hợp kết tủa là dung dịch Ba(NO3)2: Phương trình (2) và (3).
Bài 7: a) Axit sunfuric đặc được dùng làm khô không khí, hãy lấy một thí dụ. Có một số khí ẩm không được làm khô bằng axit sunfuric đặc, hãy lấy một thí dụ và cho biết vì sao.
b) Axit sunfuric đặc có thể biến nhiều hợp chất hữu cơ thành than, được gọi là sự hóa than. Lấy thí dụ về sự hóa than của glucozơ và saccarozơ. Viết sơ đồ phản ứng.
c) Sự làm khô và sự hóa than nói trên khác nhau như thế nào?
a) Axit sunfuric đặc làm khô khí CO2 nhưng không làm khô được khí H2S vì có phản ứng:
\({H_2}S + {H_2}S{O_4}\,\, \to \,\,S{O_2} \uparrow + S \downarrow + 2{H_2}O\)
b) Axut sunfuric đặc có thể biến nhiều chất hữu cơ thành than:
\(\eqalign{ & {C_6}{H_{12}}{O_6}\, \to \,\,6C + 6{H_2}O \cr & \left( {glucozo} \right) \cr & {C_{12}}{H_{22}}{O_{11}}\,\, \to \,\,12C + 11{H_2}O \cr & \left( {saccarozo} \right) \cr} \)
c) Sự làm khô: Chất không thay đổi.
Sự hóa than: Chất biến thành chất khác trong đó có cacbon.
Bài 8: Có những chất, trong phản ứng hóa học này chúng là chất khử, nhưng trong phản ứng khác chúng là chất oxi hóa. Hãy viết phương trình hóa học minh họa nhận dịnh trên cho những trường hợp sau:
Advertisements (Quảng cáo)
a) Axit;
b) Oxit bazơ;
c) Oxit axit;
d) Muối;
e) Đơn chất.
a) Axit: H2SO3
\({H_2}S{O_3} + 2{H_2}S\,\, \to \,\,3S + 3{H_2}O:\,\,{H_2}S{O_3}\) là chất oxi hóa.
\(5{H_2}S{O_3} + 2KMn{O_4}\,\, \to \,\,2MnS{O_4} + {K_2}S{O_4} \)
\(+ 2{H_2}S{O_4} + 3{H_2}O\)
\({H_2}S{O_3}\) là chất khử.
b) Oxit bazơ : FeO
\(FeO + {H_2}\,\,\buildrel {{t^0}} \over \longrightarrow Fe + {H_2}O:\,\,FeO\) là chất oxi hóa.\(2FeO + 4{H_2}S{O_{4\,đặc}}\,\,\buildrel {{t^0}} \over \longrightarrow F{e_2}{\left( {S{O_4}} \right)_3} + S{O_2} \uparrow \)
Advertisements (Quảng cáo)
\(+ 4{H_2}O\)
\(FeO\) là chất khử.
c) Oxit axit : SO2
\(S{O_2} + 2{H_2}S\,\, \to \,\,3S \downarrow + 2{H_2}O:\,\,S{O_2}\) là chất oxi hóa.
\(S{O_2} + C{l_2} + 2{H_2}O\,\, \to \,\,2HCl + {H_2}S{O_4}:\,\,S{O_2}\) là chất khử.
d) Muối : FeCl2
\(FeC{l_2} + 2C{l_2}\,\, \to \,\,2FeC{l_3}:\,\,FeC{l_2}\) là chất khử.
\(FeC{l_2} + Mg\,\, \to \,\,MgC{l_2} + Fe:\,\,FeC{l_2}\) là chất oxi hóa.
e) Đơn chất : S
\(S + 2{H_2}S{O_4}\,\buildrel {{t^0}} \over \longrightarrow 3S{O_2} \uparrow + 2{H_2}O:\,\,S\) là chất khử.
\(S + Fe\,\buildrel {{t^0}} \over \longrightarrow FeS:\,\,S\) là chất oxi hóa.
Bài 9: Có 100 ml H2SO4 98%, khối lượng riêng là 1,84 g/ml. Người ta muốn pha loãng thể tích H2SO4 trên thành dung dịch H2SO4 20%.
a) Tính thể tích nước cần dùng để pha loãng.
b) Cách pha loãng phải tiến hành như thế nào?
a) Ta có: \({m_{{H_2}S{O_4}\text{ban đầu}}} = {{100.1,84.98} \over {100}} = 180,32\,\,\left( {gam} \right)\)
Gọi lượng nước cần pha là m gam.
Theo đề bài ta có \({{180,32.100} \over {\left[ {\left( {100 + 184} \right) + m} \right]}} = 20\)
Giải ra được m = 717,6 gam vì \({D_{{H_2}O}} = 1g/ml \Rightarrow {V_{{H_2}O}} = 717,6\,ml\)
b) Cách pha loãng : Cho từ từ 100ml H2SO4 98% vào cốc chứa sẵn 717,6 ml nước rồi khuấy đều.
Bài 10: Hỗn hợp rắn X gồm có Na2SO3, NaHSO3 và Na2SO4. Cho 28,56 g X tác dụng với dung dịch H2SO4 loãng, dư. Khí SO2 sinh ra làm mất màu hoàn toàn 675 cm3 dung dịch brom 0,2M. Mặt khác 7,14g X tác dụng vừa đủ với 21,6 cm3 dung dịch KOH 0,125M.
a) Viết phương trình hóa học.
b) Tính thành phần phần trăm về khối lượng các chất trong hỗn hợp X.
a) Phản ứng xảy ra:
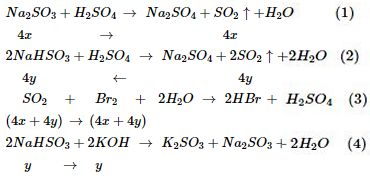
b) Đặt số mol Na2SO3, NaHSO3 và Na2SO4 trong 7,14 gam hỗn hợp X lần lượt là x mol, y mol và z mol \( \Rightarrow \) Trong 28,56 gam hỗn hợp X lần lượt là 4x mol, 4y mol và 4z mol \( \Rightarrow 126x + 104y + 142z = 7,14\,\,\,\left( * \right)\)
Ta có \({n_{B{r_2}}} = 0,2.0,675 = 0,135\,\,\left( {mol} \right);\)
\({n_{KOH}} = 0,125.{{21,6} \over {1000}} = 0,0027\,\,\left( {mol} \right)\)
Từ (1), (2) và (3)\( \Rightarrow 4x + 4y = 0,135\,\,\left( {**} \right)\)
Từ (4) \( \Rightarrow y = 0,0027\,\,\left( {***} \right)\)
Giải hệ (*), (**), (***) ta được \(\left\{ \matrix{ x = 0,03105 \hfill \cr y = 0,0027 \hfill \cr z = 0,02 \hfill \cr} \right.\)
Thành phần phần trăm khối lượng các chất trong hỗn hợp X :
\(\eqalign{ & \% {m_{N{a_2}S{O_3}}} = {{0,03.105.126} \over {7,14}}.100 = 54,79\% \cr & \% {m_{NaHS{O_3}}} = {{0,0027.104} \over {7,14}}.100 = 3,93\% \cr & \% {m_{N{a_2}S{O_4}}} = 100\% – \left( {54,79\% + 3,93\% } \right) \cr&\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\,= 41,28\% \cr} \)

