Bài 9.39: Hỗn hợp M chứa ancol no A và axit cacboxylic đơn chức B, cả hai đều mạch hở. Tổng số mol 2 chất trong hỗn hợp M là 0,5 mol. Để đốt cháy hoàn toàn hỗn hợp M cần dùng vừa hết 30,24 lít 02. Sản phẩm cháy gồm có 23,4 g \({H_2}O\) và 26,88 lít C02. Các thể tích đo ở đktc.
Hãy xác định công thức phân tử, công thức cấu tạo, tên gọi và phần trăm khối lượng từng chất trong hỗn hợp M, biết rằng chất B hơn chất A một nguyên tử cacbon.
Khi đốt 0,5 mol hỗn hơp M, số mol C02 thu đươc là : \(\frac{{26,88}}{{22,4}}\) = 1,2 (mol).
Nếu đốt 1 mol hỗn hợp M, số mol C02 thu được sẽ là 2,4 (mol).
Như vậy chất A và chất B có chứa trung bình 2,40 nguyên tử cacbon , chất A lại kém chất B 1 nguyên tử cacbon. Vậy, A có 2 và B có 3 nguyên tử cacbon.
A là ancol no có 2 cacbon : C2H6-x(OH)x hay C2H6Ox
B là axit đơn chức có 3 cacbon : C3Hy02.
Đặt số mol A là a, số mol B là b :
a + b = 0,5 (1)
C2H6Ox + \(\frac{{7 – x}}{2}\)02 \( \to \) 2C02 + 3H20
a mol \(\frac{{7 – x}}{2}a\) mol 2a mol 3a mol
C3Hy02+ \((2 + \frac{y}{4})\)02 \( \to \) 3C02 + \(\frac{y}{2}\)H20
b mol \((2 + \frac{y}{4})\)b mol 3b mol \(\frac{y}{2}\)bmol
Số mol 02 là : (3,5 – 0,5x)a + (2 + 0,25y)b = \(\frac{30,24}{22,4}\) = 1,35 (mol) (2)
Số mol C02 là : 2a + 3b = 1,2 (mol) (3)
Số mol C02 là : 3a + \(\frac{y}{2}\)b = \(\frac{23,4}{18}\) = 1,30 (mol) (4)
Giải hệ phương trình đại số tìm được : a = 0,3 ; b = 0,2 ; x = 2 ; y = 4.
Chất A : C2H602 hay 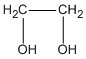 etanđiol (hay etylenglicol) chiếm \(\frac{{0,3.62}}{{0,3.62 + 0.2.72}}\). 100% = 56,4% khối lượng M.
etanđiol (hay etylenglicol) chiếm \(\frac{{0,3.62}}{{0,3.62 + 0.2.72}}\). 100% = 56,4% khối lượng M.
Chất B : C3H402 hay CH2 = CH – COOH, axit propenoic chiếm 43,64% khối lượng M.
Bài 9.40: Hỗn hợp M chứa 3 axit cacboxylic đơn chức mạch hở, trong đó hai chất là axit no kế tiếp nhau trong dãy đồng đẳng và một chất là axit không no có một liên kết kép ở gốc hiđrocacbon.
Cho 29,6 g M tác dụng với dung dịch NaOH rồi cô cạn, thu được 40,6 g hỗn hợp muối khan. Đốt cháy hoàn toàn 8,88 g M thu được 6,72 lít C02 (đktc).
Advertisements (Quảng cáo)
Xác định công thức phân tử, công thức cấu tạo, tên gọi và phần trăm khối lượng từng chất trong hỗn hợp M.
Các axit đơn chức tác dụng với NaOH như sau :
RCOOH + NaOH \( \to \) RCOONa + H20
Cứ 1 mol RCOOH biến thành 1 mol RCOONa thì khối lượng tăng thêm : 23 – 1 = 22 (g).
Khi 29,6 g M biến thành hỗn hợp muối, khối lượng đã tăng thêm : 40,6 – 29,6= 11 (g).
Vậy số mol 3 axit trong 29,60 g M là : \(\frac{{11}}{{22}} = 0,5(mol)\)
Khối lượng trung bình của 1 mol axit trong hỗn hợp là :
\(\frac{{29,6}}{{0,5}} = 59,2(g)\)
Vậy trong hỗn hợp M phải có axit có phân tử khối nhỏ hơn 59,2. Chất đó chỉ có thể là H-COOH. Nhưng M có 2 axit no kế tiếp nhau trong dãy đồng đẳng nên đã có HCOOH thì phải có CH3COOH.
Giả sử trong 8,88 g M có x mol HCOOH, y mol CH3COOH và z mol CnH2n-1COOH :
\(\left\{ \begin{array}{l}
x + y + z = \frac{{0,5.8,88}}{{29,6}} = 0,15(1)\\
46{\rm{x}} + 60y + (14n + 44)z = 8,88(2)
\end{array} \right.\)
2HCOOH + 02 \( \to \) 2C02 + 2H20
Advertisements (Quảng cáo)
x mol x mol
CH3COOH + 202 \( \to \) 2C02 + 2H20
y mol 2y mol
CnH2n-1COOH + \(\frac{{3n}}{2}\)02 \( \to \) (n + 1)C02 + nH20
z mol (n + 1)z mol
x + 2y + (n + 1)z= \(\frac{{6,72}}{{22,4}}\) = 0,3 (3)
Cách giải hệ phượng trình :
Nhân 2 vế của phương trình (3) với 14 ta có
14x + 28y + (14n + 14)z = 4,2 (3’)
Lấy (2) trừ đi (3′) :
32x + 32y + 30z = 4 68 (2′)
Nhân (1) với 30 ta có :
30x + 30y + 30z = 4,50 (1′)
Lấy (2′) trừ đi (1′) : 2x + 2y = 0,18 \( \Rightarrow \) x + y = 0,09 \( \Rightarrow \) z = 0,15 – 0,09 = 0,06
Thay các giá trị vừa tìm được vào phương trình (3), ta có :
0,09 + y + 0,06(n + 1) = 0,3
y = 0,15 – 0,06n
0 < y < 0,09 \( \Rightarrow \) 0 < 0,15 – 0,06n < 0,09
1 < n < 2,5
\( \Rightarrow \) n = 2 ; y = 0,15 – 0,06.2 = 0,03 \( \Rightarrow \) x = 0,06.
Thành phần khối lượng của hỗn hợp :
H-COOH (CH202) axit metanoic là : \(\frac{{0,06.46}}{{8,88}}\). 100% = 31,1%.
CH3-COOH (C2H402) axit etanoic là : \(\frac{{0,03.60}}{{8,88}}\). 100% = 20,3%.
CH2 = CH-COOH (C3H402) axit propenoic là: \(\frac{{0,06.72}}{{8,88}}\). 100% = 48,6%.
9.34. Độ linh động của nguyên tử H trong nhóm OH của các chất C2H5OH, C6H5OH, HCOOH và \(C{H_3}\)COOH tăng dần theo trật tự nào ?
A. C2H5OH < C6H5OH < HCOOH < \(C{H_3}\)COOH.
B. \(C{H_3}\)COOH < HCOOH < C6H5OH < C2H5OH.
C. C2H5OH < C6H5OH < \(C{H_3}\)COOH < HCOOH.
D. C6H5OH < C2H5OH < \(C{H_3}\)COOH < HCOOH.
9.35. Ghép tên với công thức cấu tạo cho phù hợp.
|
Tên chất |
Công thức cấu tạo |
||
|
1 |
axit pentanoic |
A |
\(C{H_3} – {[C{H_2}]_2} – COOH\) |
|
2 |
axit propanđioic |
B |
\(C{H_2} = CH – COOH\) |
|
3 |
axit butanoic |
C |
\(C{H_3} – COOH\) |
|
4 |
axit propenoic |
D |
\(C{H_3} – {[C{H_2}]_3} – COOH\) |
|
5 |
axit metanoic |
E |
\(H – COOH\) |
|
6 |
axit etanoic |
F |
\(C{H_2}{(COOH)_2}\) |
9.34. C
9.35.
1 – D; 2 – F; 3 – A; 4 – B; 5 – E; 6 – C

