Bài 9.31: Viết phương trình hóa học thực hiện các biến đổi dưới đây. Các chất hữu cơ được viết dưới dạng công thức cấu tạo và ghi tên.
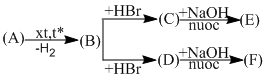
\(C{H_3} – C{H_2} – C{H_3}\)  \(C{H_3} – CH = C{H_2}\)
\(C{H_3} – CH = C{H_2}\)
A: propan
\(C{H_3} – CH = C{H_2} + HBr\) \( \to \) 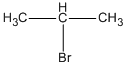
B: propen
 \( + NaOH\)
\( + NaOH\) 
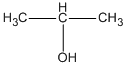 + \(NaB{\rm{r}}\)
+ \(NaB{\rm{r}}\)
C: 2-brompropan
 + CuO
+ CuO 
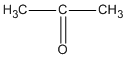 \( + Cu + {H_2}O\)
\( + Cu + {H_2}O\)
E: propan-2-ol
\(C{H_3} – CH = C{H_2} + HBr\) \( \to \) \(C{H_3} – C{H_2} – C{H_2} – B{\rm{r}}\)
\(C{H_3} – C{H_2} – C{H_2} – B{\rm{r + NaOH}}\)  \(C{H_3} – C{H_2} – C{H_2} – OH{\rm{ + NaBr}}\)
\(C{H_3} – C{H_2} – C{H_2} – OH{\rm{ + NaBr}}\)
D: 1-brompropan
\(C{H_3} – C{H_2} – C{H_2} – OH{\rm{ + CuO}}\) \( \to \) 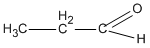 \( + Cu + {H_2}O\)
\( + Cu + {H_2}O\)
F: propan-1-ol
Bài 9.33 Chất hữu cơ A chỉ chứa cacbon, hiđro, oxi và chỉ có một loại nhóm chức.
Cho 0,9 g chất A tác dụng với lượng dư dung dịch \(AgN{O_3}\) trong amoniac, thu được 5,4 g Ag.
Cho 0,2 mol A tác dụng với \({H_2}\) có dư ( xúc tác Ni nhiệt độ ) ta được ancol B. Cho ancol B tác dụng với Na ( lấy dư ) thu được 4,48 lít \({H_2}\) (đktc).
Xác định công thức và tên chất A.
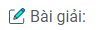
A tác dụng với dung dịch AgN03 trong amoniac tạo ra Ag ; vậy A có chức anđehit.
0,2 mol anđehit kết hợp với hiđro phải tạo ra 0,2 mol ancol B có công thức R(CH2OH)x
R(CH2OH)x + xNa \( \to \) R(CH2ONa)x + \(\frac{x}{2}\)H2
Theo phương trình 1 mol B tạo ra \(\frac{x}{2}\) mol H2
Theo đầu bài 0,2 mol B tạo ra 0,2 mol H2
\(\frac{1}{{0,2}} = \frac{x}{{0,4}} \Rightarrow x = 2\)
Vậy B là ancol hai chức và A là anđehit hai chức.
R(CHO)2 + 4AgN03 + 6NH3 + 2H20 \( \to \) R(COONH4)2 + 4NH4NO3 + 4Ag\( \downarrow \)
Số mol anđehit A = \(\frac{x}{4}\)số mol Ag = \(\frac{1}{4}.\frac{{5,4}}{{108}}\) = 0,0125 (mol)
Advertisements (Quảng cáo)
Khối lượng 1 mol A = \(\frac{{0,9}}{{0,0125}}\) = 72(g).
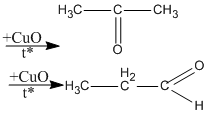
R(CHO)2 = 72 \( \Rightarrow \) R = 72 – 2.29 = 14. Vậy R là \(C{H_2}\)
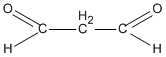 propanđial
propanđial
Bài 9.34: Chất hữu cơ X chỉ có chức anđehit. Biết 0,1 mol X có thể kết hợp với 4,48 lít \({H_2}\) (lấy ở đktc) khi có chất xúc tác Ni và nhiệt độ thích hợp.
Mặt khác, nếu cho 7 g X tác dụng với lượng dư dung dịch \(AgN{O_3}\) trong amoniac, thu được 27 g Ag.
Hãy xác định công thức phân tử, công thức cấu tạo và tên của chất X.
Theo đầu bài 0,1 mol anđehit X kết hợp được với 0,2 mol H2. Vậy X có thể là :
– Anđehit no hai chức CnH2n (CHO)2 hoặc
– Anđehit đơn chức có 1 liên kết đôi ở gốc CnH2n-1CHO.
1. Nếu X là CnH2n(CHO)2 thì :
CnH2n(CHO)2 + 4AgN03 + 6NH3 + 2H20 \( \to {C_n}{H_{2n}}{(COON{H_4})_2} + 4N{H_4}N{O_3} + 4Ag \downarrow \)
Số mol X = \(\frac{1}{4}\)số mol Ag = \(\frac{1}{4}.\frac{{27}}{{108}} = {6,25.10^{ – 2}}\) (mol).
Mx = \(\frac{7}{{{{6,25.10}^{ – 2}}}}\) =112 (g/mol)
\({M_{{C_n}{H_{2n}}{{(CHO)}_2}}}\) = 112 (g/mol) hay 14n + 2.29 = 112 \( \Rightarrow \) n = 3,86 (loại)
2. Nếu X là CnH2n-1CHO :
CnH2n-1CHO + 2AgN03 + 3NH3 + H20 \( \to \) CnH2n-1COONH4 + 2\(N{H_4}N{O_3}\) + 2Ag\( \downarrow \)
Số mol X = \(\frac{1}{2}\)Số mol Ag = \(\frac{1}{2}.\frac{{27}}{{108}} = {1,25.10^{ – 1}}\) (mol).
Mx = \(\frac{7}{{{{1,25.10}^{ – 1}}}}\) = 56 (g/mol)
Advertisements (Quảng cáo)
\({M_{{C_n}{H_{2n – 1}}CHO}}\) = 56 (g/mol) \( \Rightarrow \) 14n + 28 = 56 \( \Rightarrow \) n = 2
CTPT : \({C_3}{H_4}O\)
CTCT: CH2 = CH-CHO propenal.
Bài 9.35: Hỗn hợp M chứa ba hợp chất hữu cơ X, Y và Z. Hai chất X và Y kế tiếp nhau trong một dãy đồng đẳng ( \({M_Y} > {M_X}\) ). Chất Z là đồng phân của chất Y.
Nếu làm bay hơi 3,2 g M thì thể tích hơi thu được đúng bằng thể tích của 1,68g khí nitơ ở cùng điều kiện.
Để đốt cháy hoàn toàn 16g M cần dùng vừa hết 23,52 lít \({O_2}\) (đktc). Sản phẩm cháy chỉ có \(C{O_2}\) và \({H_2}O\) với số mol bằng nhau.
Nếu cho 48g M tác dụng với Na(lấy dư), thu được 1,68 lít \({H_2}\)(đktc).
Hãy xác địng công thức phân tử, công thức cấu tạo, tên và phần trăm về khối lượng của từng chất trong hỗn hợp M.
Số mol 3 chất trong 3,20 g hỗn hợp M : \(\frac{{1,68}}{{28}}\) = 0,06 (mol).
Số mol 3 chất trong 16 g M : \(\frac{{0,06.16}}{{3,2}}\) = 0,3 (mol)
Khi đốt hỗn hợp M ta chỉ thu được C02 và H20.
Vậy, các chất trong hỗn hợp đó chỉ có thể chứa C, H và O.
Đặt công thức chất X là CxHyOz thì chất Y là Cx+1Hy+2Oz.Chất Z là đồng phân của Y nên công thức phân tử giống chất Y.
Giả sử trong 16 g hỗn hợp M có a mol chất X và b mol hai chất Y và Z :
\(\left\{ \begin{array}{l}
a + b = 0,3(1)\\
(12{\rm{x}} + y + 16{\rm{z}})a + (12{\rm{x}} + y + 16{\rm{z}} + 14)b = 16(2)
\end{array} \right.\)
Khi đốt 16 g M thì tổng khối lượng C02 và H20 thu được bằng tổng khối lượng của M và 02 và bằng :
\(16 + \frac{{23,52}}{{22,4}}.32 = 49,6(g)\)
Mặt khác, số mol C02 = số mol H20 = n :
44n + 18n = 49,6 \( \Rightarrow \) n = 0,8
\({C_x}{H_y}{O_z} + (x + \frac{y}{4} – \frac{z}{2}){O_2} \to xC{O_2} + \frac{y}{2}{H_2}O\)
a mol xa mol \(\frac{y}{2}\)a mol
\({C_{x + 1}}{H_{y + 2}}{O_z} + (x + \frac{y}{4} – \frac{z}{2} + 1,5){O_2}\)\( \to (x + 1)C{O_2} + \frac{{y + 2}}{2}{H_2}O\)
b mol (x + 1)b mol \(\frac{{y + 2}}{2}\)b mol
Số mol C02 là : xa + (x + 1)b = 0,8 (mol) (3)
Số mol H20 là : \(\frac{{y{\rm{a}} + (y + 2)b}}{2}\) = 0,8 (mol)
do đó : ya + (y + 2)b = 1,6 (4)
Giải hệ phương trình :
Biến đổi (3) ta có x(a + b) + b = 0,8
Vì a + b = 0,3 nên b = 0,8 – 0,3x
Vì 0 < b < 0,3 nên 0 < 0,8 – 0,3x < 0,3 \( \Rightarrow \) 1,66 < x < 2,66
x nguyên \( \Rightarrow \) x = 2 \( \Rightarrow \) b = 0,8 – 0,3.2 = 0,2
\( \Rightarrow \) a = 0,3 – 0,2 = 0,1
Thay giá trị của a và b vào (4), tìm được y = 4.
Thay giá trị của a, b, x và y vào (2), tìm được z = 1.
Vậy chất X có CTPT là C2H40, hai chất Y và z có cùng CTPT là C3H60.
Chất X chỉ có thể có CTCT là 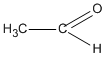 (etanal) vì chất CH2 = CH – OH không bền và chuyển ngay thành etanal.
(etanal) vì chất CH2 = CH – OH không bền và chuyển ngay thành etanal.
Chất Y là đồng đẳng của X nên CTCT là 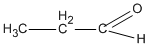 (propanal).
(propanal).
Hỗn hợp M có phản ứng với Na. Vậy, chất Z phải là ancol CH2 = CH – CH2 – OH (propenol) :
2CH2 = CH – CH2 – OH + 2Na \( \to \) 2CH2 = CH – CH2 – ONa + H2\( \uparrow \)
Số mol Z trong 48 g M là : 2.số mol H2 = 2.\(\frac{{1,68}}{{22,4}}\) =0,15 (mol).
Số mol z trong 16 g M là : \(\frac{{0,15.16}}{{48}}\) = 0,05 (mol)
Số mol Y trong 16 g M là : 0,2 – 0,05 = 0,15 (mol).
Thành phần khối lượng của hỗn hợp M :
Chất X chiếm : \(\frac{{0,1.44}}{{16}}\). 100% = 27,5%.
Chất Y chiếm : \(\frac{{0,15.58}}{{16}}\). 100% = 54,4%.
Chất Z chiếm : \(\frac{{0,05.58}}{{16}}\). 100% = 18,1%.

