Bài 9.6: a) Tính khối lượng bằng gam của :
-6,02.1023 phân tử nước H20,
-6,02.1023 phân tử cacbon đioxit CO2,
-6,02.1023 phân tử canxi cacbonat CaCO3.
b) Nêu nhận xét về số trị của các giá trị khối lượng tính được này và số trị phân tử khối của mỗi chất.
(Xem lại bài tập 8.9*. trước khi làm bài tập này).

a) Khối lượng tính bằng gam của : 6,02.1023 phân từ nước (phân tử khối là 18 đvC) bằng :
6,02.1023 X 18 X 1,66 X 10-24 g.
= 18 X 6,02 X 1,66 X 1023 X 1024 g
≈ 18 X 10 X 1023 x 10-24 g
≈18 X 1024 x 10-24=18 g
Advertisements (Quảng cáo)
Khối lượng tính bằng gam của 6,02. 1023 phân tử CO2
[phân tử khối bằng : 12 + 2 x 16 = 44 (đvC)] và cùa 6,02. 1023 phân tử CaCO ;
[phân tử khối bằng : 40 + 12 + 3 x 16 = 100 (đvC)] theo thứ tự bằng (đặt tính như trên) : 44 g và 100 g.
b) Số trị của các giá trị khối lượng tính được bằng chính số trị phân tử khối của mỗi chất.
Bài 9.7: Thực nghiệm cho biết nguyên tố natri chiếm 59% về khối lượng trong hợp chất với nguyên tố lưu huỳnh.
Viết công thức hoá học và tính phân tử khối của hợp chất.
{Hướng dẫn : Để viết đúng công thức hoá học của hợp chất AxBy phải xác định được các chỉ số X, y. Biết rằng, tỉ lệ phần trăm về khối lượng giữa hai nguyên tố trong hợp chất bằng đúng tỉ lệ khối lượng giữa hai nguyên tố trong 1 phân tử. Từ đây có các tỉ lệ như sau :
Advertisements (Quảng cáo)
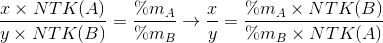
Tính và rút gọn thành tỉ lệ hai số nguyên đơn giản nhất, thông thường thì X, y là hai số nguyên này. Ngoài ra, nếu biết trước phân tử khối của AxBy thì xác định được chắc chắn X và y, không tính dựa theo tỉ lệ như trên).

Gọi công thức của hợp chất là 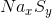 .Theo đè bài ta có
.Theo đè bài ta có
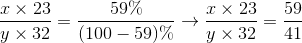
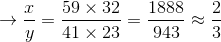
Công thức hóa học của hợp chất: 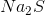
Phân tử khối bằng 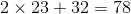 (đvC)
(đvC)
Bài 9.8: Hợp chất A tạo bởi hai nguyên tố là nitơ và oxi. Người ta xác định được
rằng, tỉ lê khối lương giữa hai nguyên tố trong A bằng : 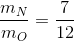
Viết công thức hoá học và tính phân tử khối của A.
(jHướng dẫn : Biết rằng, tỉ lệ khối lượng giữa hai nguyên tố trong hợp chất AxBy cũng bằng đúng tỉ lệ khối lượng giữa hai nguyên tố trong 1 phân tử. Vì vậy tiến hành tương tự như đã hướng dẫn ở bài tập 9.7*, chỉ khác là trong đó thay %mA bằng mA và %mB bằng mB).
Trả lời
Gọi công thức của A là 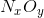 .Theo đề bài ta có
.Theo đề bài ta có
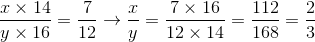
Vậy x=2, y=3.
Công thức hóa học của hợp chất 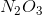
Phân tử khối bằng : 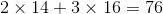 (đvC)
(đvC)

