Bài 10.8: a) Biết Cr (crom) có hai hoá trị thường gặp là II và III, hãy chọn những công thức hoá học đúng trong số các công thức cho sau đây :
(1) CrSO4 ; (2) Cr2S04 ; (3) CrO ; (4) CrO2
(5) Cr(SO4)2 ; (6) Cr2(SO4)3. (7) Cr2O ; (8) Cr2O3
b) Tính phân tử khối của những chất biểu diễn bởi công thức hoá học đúng.
Trả lời
a) Những công thức hoá học đúng :
Cr hoá trị II : CrSO4, CrO.
Cr hoá trị III : Cr2(SO4)3, Cr2O3.
b) Phân tử khối của những chất biểu diễn bởi các công thức hoá học này :
CrSO4 = 52 + 32 + 4 x 16 = 148 (đvC),
CrO = 52 + 16 = 68 (đvC).
Cr2(SO4)3 = 2 x 52 + 3(32 + 4 X 16) = 392 (đvC),
Advertisements (Quảng cáo)
Cr2O3 = 2 x 52 + 3 x 16 = 152 (đvC).
Bài 10.9: Người ta xác định được rằng, nguyên tố silic (Si) chiếm 87,5% về khối lượng trong hợp chất với nguyên tố hiđro.
Viết công thức hoá học và tính phân tử khối của hợp chất.
Xác định hoá trị của silic trong hợp chất.
(Xem lại hướng dẫn bài tập 9.7* trước khi làm bài tập này).
Trả lời
Advertisements (Quảng cáo)
Gọi công thức hợp chất là 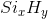 . Theo đề bài ta có
. Theo đề bài ta có
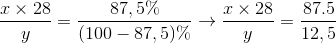
Công thức hóa học của hợp chất : 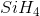
Phân tử khối bằng : 28+4=32(đvC)
b) Hóa trị của Si trong hợp chất là : IV
Bài 10.10: Phân tích một mẫu hợp chất tạo bởi hai nguyên tố là sắt và oxi. Kết quả cho thấy cứ 7 phần khối lượng sắt có tương ứng với 3 phần khối lượng oxi.
Viết công thức hoá học và tính phân tử khối của hợp chất.
Xác định hoá trị của sắt trong hợp chất.
(Xem lại hướng dẫn bài tập 9.8* trước khi làm bài tập này).
Trả lời
Gọi công thức của hợp chất là  . Theo đề bài ra, ta có
. Theo đề bài ra, ta có
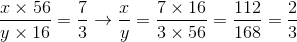
Vậy x=2, y=3
Công thức hóa học của hợp chất là 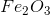
Phân tử khối bằng

b) Hóa trị của Fe trong hợp chất là : III

