Bài 5.91: Trình bày phương pháp hoá học điều chế các kim loại từ các dung dịch muối riêng biệt : NaCl, CuCl2, FeCl3. Viết phương trình hoá học của các phản ứng.
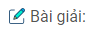
+) Cô cạn dung dịch NaCl, lấy NaCl khan rồi điện phân nóng chảy
\(2NaCl\buildrel {dpnc} \over
\longrightarrow 2Na + C{l_2}\)
+) Có thể điện phân dung dịch CuCl2 :
\(CuC{l_2}\buildrel {dp{\rm{dd}}} \over
\longrightarrow Cu{\rm{ }} + {\rm{ }}C{l_2}\)
hoặc : \(CuC{l_2}\buildrel { + NaOH} \over
\longrightarrow Cu{(OH)_2}\buildrel {{t^0}} \over
\longrightarrow CuO\buildrel { + {H_2},{t^0}} \over
\longrightarrow Cu\)
\( + )FeC{l_3}\buildrel { + NaOH} \over
\longrightarrow Fe{(OH)_3}\buildrel {{t^0}} \over
\longrightarrow F{e_2}{O_3}\buildrel { + CO,{t^0}} \over
\longrightarrow Fe\)
Bài 5.92: Từ những hợp chất riêng biệt : Cu(OH)2, MgO, FeS2, hãy nêu phương pháp thích hợp để điều chế Cu, Mg, Fe. Viết phương trình hoá học của các phản ứng.
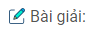
\(\eqalign{
& Cu{(OH)_2} \to CuC{l_2}\buildrel {dp{\rm{dd}}} \over
\longrightarrow Cu \cr
& MgO \to MgC{l_2}\buildrel {dpnc} \over
\longrightarrow Mg \cr
& Fe{S_2} \to F{e_2}{O_3} \to Fe \cr
& 4Fe{S_2} + 11{O_2}\buildrel {{t^0}} \over
\longrightarrow 2F{e_2}{O_3} + 8S{O_2} \cr
& F{e_2}{O_3} + 3CO\buildrel {{t^0}} \over
\longrightarrow 2Fe + 3C{O_2} \cr} \)
Bài 5.93: Bằng những phương pháp nào người ta có thể điều chế Cu từ dung dịch Cu(NO3)2, Ca từ dung dịch CaCl2? Viết phương trình hoá học của các phản ứng.
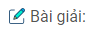
– Điều chế Cu từ Cu(NO3)2 :
Advertisements (Quảng cáo)
\(\matrix{
{2Cu{{\left( {N{O_3}} \right)}_2} + {\rm{ }}2{H_2}O{\rm{ }}\buildrel {dp{\rm{dd}}} \over
\longrightarrow 2Cu{\rm{ }} + {\rm{ }}{O_2} + {\rm{ }}4HN{O_3}} \hfill \cr
{{\rm{ hay }}Fe{\rm{ }} + {\rm{ }}Cu{{\left( {N{O_3}} \right)}_2} \to Fe{{\left( {N{O_3}} \right)}_2} + Cu} \hfill \cr
{2Cu{{\left( {N{O_3}} \right)}_2}\buildrel {{t^0}} \over
\longrightarrow 2CuO{\rm{ }} + {\rm{ }}4N{O_2} + {\rm{ }}{O_2}} \hfill \cr
{CuO{\rm{ }} + {\rm{ }}{H_2}\buildrel {{t^0}} \over
\longrightarrow Cu{\rm{ }} + {\rm{ }}{H_2}O} \hfill \cr}\)
Điều chế Ca từ CaCl2 : cô cạn dung dịch CaCl2 rồi điện phân nóng chảy.
\(CaC{l_2}\buildrel {dpnc} \over
\longrightarrow Ca{\rm{ }} + {\rm{ }}C{l_2}\)
Bài 5.94: Trình bày phương pháp hoá học điều chế các kim loại Ca, Na, Cu từ những muối riêng biệt: CaCO3, Na2SO4, Cu2S.
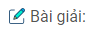
Có thể điểu chế kim loại theo các sơ đồ sau :
\(\eqalign{
& a)CaC{O_3}\buildrel { + HCl} \over
\longrightarrow CaC{l_2}\buildrel {dpnc} \over
\longrightarrow Ca \cr
& b)N{a_2}S{O_4}\buildrel { + BaC{l_2}} \over
\longrightarrow NaCl\buildrel {dpnc} \over
\longrightarrow Na \cr
& c)C{u_2}S\buildrel { + {O_2}} \over
\longrightarrow CuO\buildrel { + {H_2}} \over
\longrightarrow Cu \cr
& CuO\buildrel { + HCl} \over
\longrightarrow CuC{l_2}\buildrel {dp{\rm{dd}}} \over
\longrightarrow Cu \cr} \)
Bài 5.95: Từ các chất riêng biệt : CuSO4, CaCO3, FeS cần điều chế được các kim loại Cu, Ca, Fe. Viết PTHH của các phản ứng xảy ra. (Các điều kiện khác có đủ).
Advertisements (Quảng cáo)
Điều chế Cu:
\(2CuS{O_4} + 2{H_2}O\buildrel {{\rm{dpdd}}} \over
\longrightarrow 2Cu + {O_2} + 2{H_2}S{O_4}\)
Điều chế Ca: CaCO3 + 2HCl → CaCl2 + H2O + CO2\(CaC{l_2}\buildrel {dpnc} \over\longrightarrow Ca + C{l_2}\)
Điều chế Fe: FeS+ 2HCl → FeCl2 + H2S
\(FeC{l_2}\buildrel {dpnc} \over
\longrightarrow Fe + C{l_2}\)
Bài 5.96: Điện phân (điện cực trơ) dung dịch X chứa 0,2 mol CuSO4và 0,12 mol NaCl bằng dòng điện có cường độ 2A. Tính thể tích khí (đktc) thoát ra ở anot sau 9650 giây điện phân.
Trong quá trình điện phân cation nào có tính oxi hoá mạnh hơn sẽ thu e trước, anion nào có tính khử mạnh hơn sẽ nhường e trước. Trong dung dịch đã cho thứ tự như sau :
– Ở catot: Cu2+ > H+(H2O) > Na+
– Ở anot: Cl– > OH–(H2O) > SO42-
Ghép các ion thành phân tử để viết pt điện phân. Các ion Cl– và Cu2+ điện phân trước
\(CuC{l_2}\buildrel {dp{\rm{dd}}} \over
\longrightarrow Cu + C{l_2}(1)\)
0,06mol→ 0,06→0,06
\(2CuS{O_4} + 2{H_2}O\buildrel {{\rm{dpdd}}} \over
\longrightarrow 2Cu + {O_2} + 2{H_2}S{O_4}\) (2)
Thời gian cần thiết để điện phân ở (1):
\(m = {{A.I.t} \over {n.F}} \to t = {{m.n.F} \over {A.I}} = {{71.0,06.2.96500} \over {2.71}} = 5790(s)\)
Thời gian còn lại để điện phân (2) là: 9650- 5790= 3860 (s)
Tính khối lượng O2 thu được khi điện phân trong 3860 s:
\(\eqalign{
& m = {{AIt} \over {nF}} = {{32.2.3860} \over {4.96500}} = 0,64g \cr
& {n_{{O_2}}} = {{0,64} \over {32}} = 0,02mol \cr} \)
Tổng số mol khí thu được ở anot là: 0,06+0,02=0,08 mol
Thể tích khí thu được ở anot là: 0,08.22,4=1,792 (l).

