Bài 2.36: Cho các chất sau : Ca3(PO4)2, \({P_2}{O_5}\), P, \({H_3}P{O_4}\), NaH2PO4, \(N{H_4}{H_2}P{O_4}\), Na3PO4, Ag3PO4. Hãy lập một dãy biến hoá biểu diễn quan hộ giữa các chất trên. Viết các phương trình hoá học và nêu rõ phản ứng thuộc loại nào.
Dãy biến hoá biểu diễn quan hệ giữa các chất có thể là :
Ca3(PO4)2 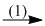 P
P 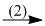 P2O5
P2O5  \({H_3}P{O_4}\)
\({H_3}P{O_4}\) 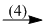 NH4H2PO4
NH4H2PO4 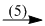 NaH2PO4
NaH2PO4 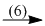 Na3PO4
Na3PO4 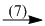 Ag3PO4
Ag3PO4
Các phương trình hoá học :
(1) Ca3(PO4)2 + 3SiO2 + 5C 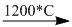 2P + 3CaSiO3 + 5CO
2P + 3CaSiO3 + 5CO
(2) 4P + 5O2 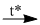 2P2O5
2P2O5
(3) P2O5 + 3H2O \( \to \) 2H3PO4
(4) H3PO4 + NH3 \( \to \) NH4H2PO4
(5) NH4H2PO4 + NaOH \( \to \) NaH2PO4 + NH3 + H2O
(6) NaH2PO4 + 2NaOH \( \to \) Na3PO4 + 2H2O
(7) Na3PO4 + 3AgNO3 \( \to \) Ag3PO4 + 3NaNO3
Các phản ứng (1), (2) thuộc loại phản ứng oxi hoá – khử, các phản ứng còn lại thuộc loại phản ứng không phải oxi hoá – khử. Các phản ứng (2), (3), (4) còn được gọi là phản ứng hoá hợp. Các phản ứng (5), (6), (7) còn được gọi là phản ứng trao đổi.
Bài 2.37: Bằng phương pháp hoá học phân biệt các muối : Na3PO4, NaCl, NaBr, Na2S, NaNO3. Nêu rõ hiện tượng dùng để phân biệt và viết phương trình hoá học của các phản ứng.
Advertisements (Quảng cáo)
Dùng dung dịch AgNO3 để phân biệt các muối : Na3PO4, NaCl, NaBr. Na2S, NaNO3.
Lấy mỗi muối một ít vào từng ống nghiệm, thêm nước vào mỗi ống và lắc cẩn thận để hoà tan hết muối. Nhỏ dung dịch AgNO3 vào từng ống nghiệm.
– Ở dung dịch nào có kết tủa màu trắng không tan trong axit mạnh, thì đó là dung dịch NaCl :
NaCl + AgNO3 \( \to \) AgCl\( \downarrow \) + NaNO3
(màu trắng)
– Ở dung dịch nào có kết tủa màu vàng nhạt không tan trong axit mạnh, thì đó là dung dịch NaBr :
NaBr + AgNO3 \( \to \) AgBr\( \downarrow \) + NaNO3
(màu vàng nhạt)
– Ở dung dịch nào có kết tủa màu đen, thì đó là dung dịch Na2S :
Advertisements (Quảng cáo)
Na2S + 2AgNO3 \( \to \) Ag2S\( \downarrow \) + 2NaNO3
(màu đen)
– Ở dung dịch nào có kết tủa màu vàng tan trong axit mạnh, thì đó là dung dịch Na3PO4 :
Na3PO4 + 3AgNO3 \( \to \) Na3PO4 + 3NaNO3
(màu vàng)
– Ở dung dịch không có hiện tượng gì là dung dịch NaNO3.
Bài 2.38: Cho 62 g canxi photphat tác dụng với 49 g dung dịch axit sunfuric 64%. Làm bay hơi dung dịch thu được đến cạn khô thì được một hỗn hợp rắn. Xác định thành phần khối lượng của hỗn hợp rắn, biết rằng các phản ứng đều xảy ra với hiệu suất 100%.
Canxi photphat có thể phản ứng với axit suníuric theo các phương trình hoá học :
Ca3(PO4)2 + H2SO4 \( \to \) 2CaHPO4 + CaSO4 (1)
Ca3(PO4)2 + 2H2SO4 \( \to \) Ca(H2PO4)2 + 2CaSO4 (2)
Ca3(PO4)2 + 3H2SO4 \( \to \) 2H3PO4 + 3CaSO4 (3)
Số mol Ca3(PO4)2 : \(\frac{{62}}{{310}}\) = 0,2 (mol).
Số mol H2SO4 : \(\frac{{49.64}}{{100.98}}\) = 0,32 (mol).
Vì tỉ lệ số mol H2SO4 và Ca3(PO4)2 là :
\(1 < \frac{{0,32}}{{0,2}} = 1,6 < 2\)
nên H2SO4 chỉ đủ để tạo ra hai muối CaHPO4 và Ca(H2PO4)2 theo các phương trình hóa học (1) và (2).
Gọi a và b là số mol Ca3(PO4)2 tham gia các phản ứng (1) và (2), thì số mol H2SO4 tham gia phản ứng là a + 2b. Ta có hệ phương trình :
\(\left\{ \begin{array}{l}
a + 2b = 0,32\\
a + b = 0,2
\end{array} \right.\)
Giải hệ phương trình được : a = 0,08 và b = 0,12.
\( \Rightarrow \) \({m_{CaHP{O_4}}}\) = 2.0,08.136 = 21,76 (g) ;
\({m_{Ca{{({H_2}P{O_4})}_2}}}\) = 0,12.234 = 28,08 (g);
\({m_{CaS{O_4}}}\) = (a + 2b).136 = (0,08 + 0,24).136 = 45,52 (g).

