Bài 12 Phân bón hóa học SBT Hóa lớp 11. Giải bài 2.43, 2.44, 2.45 trang 19. Câu 2.43: Viết phương trình hoá học thực hiện dãy chuyển hoá sau…; Tính tỉ lệ % P2O5 trong mẫu supephotphat đơn ?
Bài 2.43: Viết phương trình hoá học thực hiện dãy chuyển hoá sau :
Bột photphorit  axit photphoric
axit photphoric  amophot
amophot  canxiphotphat
canxiphotphat  axit photphoric
axit photphoric 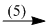 supephotphat kép.
supephotphat kép.
Các phương trình hoá học thực hiện dãy chuyển hoá :
(1) \(C{a_3}{(P{O_4})_2} + 3{H_2}S{O_{4(dac)}} \to 2{H_3}P{O_4} + 3CaS{O_{4 \downarrow }}\)
(2) \(3N{H_3} + 2{H_3}P{O_4} \to N{H_4}{H_2}P{O_4} + {(N{H_4})_2}HP{O_4}\)
amophot
(3) \(N{H_4}{H_2}P{O_4} + {(N{H_4})_2}HP{O_4} + 3Ca{(OH)_{2du}}\)\( \to C{a_3}{(P{O_4})_2} + 3N{H_3} + 6{H_2}O\)
(4) \(C{a_3}{(P{O_4})_2} + 3Si{O_2} + 5C\)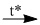 \(2P + 3CaSi{O_3} + 5CO\)
\(2P + 3CaSi{O_3} + 5CO\)
\(P + 5HN{O_{3(dac)}} \to {H_3}P{O_4} + 5N{O_2} + {H_2}O\)
(5) \(C{a_3}{(P{O_4})_2} + 4{H_3}P{O_4} \to 3Ca{({H_2}P{O_4})_2}\)
Advertisements (Quảng cáo)
Bài 2.44: Một mẫu supephotphat đơn khối lượng 15,55 g chứa 35,43% Ca(H2PO4)2, còn lại là CaSO4. Tính tỉ lệ % P2O5 trong mẫu supephotphat đơn trên.
Khối lượng Ca(H2PO4)2 trong 15,55 g supephotphat đơn :
\(\frac{{15,55.35,43}}{{100}}\) = 5,51 (g)
Khối lượng P2O5 trong mẫu supephotphat đơn trên :
1 Ca(H2P04)2 – 1 P2O5
\(\left. \begin{array}{l}
1mol(234g) – 1mol(142g)\\
5,51g – xg
\end{array} \right\}x = \frac{{5,51.142}}{{234}} = 3,344(g){P_2}{O_5}\)
Advertisements (Quảng cáo)
% về khối lượng của P2O5 : \(\frac{{3,344.100\% }}{{15,55}}\) = 21,5%
Bài 2.45: Cho 40,32 m3 amoniac (đktc) tác dụng với 147 kg axit photphoric tạo thành một loại phân bón amophot có tỉ lệ số mol
\({n_{N{H_4}{H_2}P{O_4}}}:{n_{{{(N{H_4})}_2}HP{O_4}}} = 4:1\)
1. Viết phương trình hoá học của phản ứng tạo thành phân bón amophot đó.
2. Tính khối lượng (kg) của amophot thu được.
1. Phương trình hoá học tạo thành loại phân bón amophot phù hợp với đề bài :
\(6N{H_3} + 5{H_3}P{O_4} \to 4N{H_4}{H_2}P{O_4} + {(N{H_4})_2}HP{O_4}\) (1)
2. Tính khối lượng amophot thu được :
Số mol \(N{H_3}\) : \(\frac{{40,32.1000}}{{22,4}}\) = 1800 (mol).
Số mol \({H_3}P{O_4}\) : \(\frac{{147.1000}}{{98}}\) = 1500 (mol).
Tỉ lệ số mol \(N{H_3}\) : số mol \({H_3}P{O_4}\) = 1800 : 1500 = 6:5, vừa đúng bằng tỉ lệ hợp thức trong phương trình hoá học (1). Vậy, lượng \(N{H_3}\) phản ứng vừa đủ với lượng \({H_3}P{O_4}\). Do đó, có thể tính lượng chất sản phẩm thec \(N{H_3}\) hoặc theo \({H_3}P{O_4}\).
Theo lượng \({H_3}P{O_4}\), số mol \(N{H_4}{H_2}P{O_4}\) : \(\frac{{1500.4}}{5}\) = 1200 (mol).
và số mol \({(N{H_4})_2}HP{O_4}\) : \(\frac{{1500}}{5}\) = 300,0 (mol).
Khối lượng amophot thu được :
\({m_{N{H_4}{H_2}P{O_4}}} + {m_{{{(N{H_4})}_2}HP{O_4}}}\) = 1200.115+300.132 = 177,6.103 (g), hay 177,6 kg.

