Bài 10: Photpho Sách bài tập hóa học 11. Giải bài 2.28, 2.29, 2.30, 2.31, 2.32 trang 16, 17. Câu 2.28: Hãy chọn nửa câu ở cột (II) ghép với nửa câu ở cột (I) để được câu phù hợp…; Xác định số oxi hoá của photpho trong các hợp chất và ion sau ?
Bài trắc nghiệm 2.28, 2.29
2.28. Hãy chọn nửa câu ở cột (II) ghép với nửa câu ở cột (I) để được câu phù hợp :
|
Cột (I) |
Cột (II) |
|
A. Nguyên tử photpho có … B. Nguyên tố photpho có … C. Nguyên tử photpho có phân lớp 3 d … D. Ở trên 40*C, photpho trắng tự bốc cháy trong không khí … E. Photpho đỏ chỉ bốc cháy trong không khí … G. Ở nhiệt độ thường photpho trắng phát quang … |
1. độ âm điện nhỏ hơn so với nguyên tố nitơ. 2. còn để trống, không có các electron. 3. điện tích hạt nhân lớn hơn so với nguyên tử nitơ. 4. trong bóng tối. 5. khi đun nóng đến 250*C. 6. nên phải ngâm trong nước. 7. Khi chiếu sáng. |
2.29. Đốt cháy hoàn toàn 6,2 g photpho trong oxi lấy dư. Cho sản phẩm tạo thành tác dụng với 150 ml dung dịch NaOH 2M. Sau phản ứng, trong dung dịch thu được có các muối :
A. NaH2PƠ4 và Na2HPƠ4
B. Na2HPO4 và Na3PO4
C. NaH2PO4 và Na3PO4
D. Na3PO4.
2.28. A – 3; B – 1; C-2; D-6; E-5; G-4.
2.29. A
4P+5O2 \( \to \) 2P2O5 (1)
P2O5 + 2NaOH + H2O \( \to \) 2NaH2PO4 (2)
P2O5 + 4NaOH \( \to \) 2Na2HPO4 + H2O (3)
P2O5 + 6NaOH \( \to \) 2Na3PO4 + 3H2O (4)
Số mol photpho : nP = \(\frac{{6,2}}{{31}}\) = 0,2 (mol).
Số mol NaOH : nNaOH = \(\frac{{150.2}}{{1000}}\) = 0,3 (mol)
Sản phẩm tạo thành khi đốt photpho là P2O5.
Theo (1), số mol P2O5 = \(\frac{1}{2}\).nP = \(\frac{0,2}{2}\) =0,1 (mol).
Advertisements (Quảng cáo)
Ti lệ số mol NaOH và P2O5 : \(\frac{{{n_{NaOH}}}}{{{n_{{P_2}{O_5}}}}} = \frac{{0,3}}{{0,1}} = 3\)
Tỉ lệ số mol nằm trong khoảng 2 và 4, do đó theo các phản ứng (2) và (3) trong dung dịch thu được có hai muối được tạo thành là NaH2P04 và Na2HP04.
Bài 2.30: Xác định số oxi hoá của photpho trong các hợp chất và ion sau đây :
PH3, \(P{O_4}^{3 – }\), \({H_2}P{O_4}^ – \), \(HP{O_4}^{2 – }\), P2O3, PCl5, HPO3, H4P2O7.
Số oxi hoá của photpho trong các hợp chất và ion :
PH3: -3; \(P{O_4}^{3 – }\): +5; \({H_2}P{O_4}^ – \): +5; \(HP{O_4}^{2 – }\): +5; P2O3: +3; PCl5: +5; HPO3: +5; H4P2O7: +5.
Bài 2.31: Viết các phương trình hóa học thực hiện sơ đồ chuyển hóa sau :
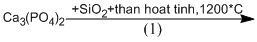
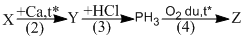
(1) \(C{a_3}{(P{O_4})_2} + 3Si{O_2} + 5C\)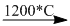 \(2P + 3CaSi{O_3} + 5CO\)
\(2P + 3CaSi{O_3} + 5CO\)
Advertisements (Quảng cáo)
X là P
(2) \(2P + 3Ca\)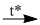 \(C{a_3}{P_2}\)
\(C{a_3}{P_2}\)
Y là \(C{a_3}{P_2}\)
(3) \(C{a_3}{P_2} + 6HCl \to 3CaC{l_2} + 2P{H_3}\)
(4) \(2P{H_3} + 4{O_2}\)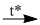 \({P_2}{O_5} + 3{H_2}O\)
\({P_2}{O_5} + 3{H_2}O\)
Z là \({P_2}{O_5}\)
Bài 2.32: Đốt cháy a gam photpho đỏ trong không khí lấy dư, rồi cho sản phẩm thu được vào 500 ml dung dịch \({H_3}P{O_4}\) 85% (D = 1,7 g/ml). Sau khi phản ứng xảy ra hoàn toàn nồng độ của dung dịch \({H_3}P{O_4}\) xác định được là 92,6%. Tính giá trị của a.
Photpho cháy trong không khí lấy dư theo phản ứng :
\(4P + 5{O_2}\)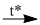 \(2{P_2}{O_5}\) (1)
\(2{P_2}{O_5}\) (1)
4 mol (4.31 g) 2 mol (2.142 g)
P2O5 tác dụng với tạo thành \({H_3}P{O_4}\) theo phản ứng :
\({P_2}{O_5} + 3{H_2}O \to 2{H_3}P{O_4}\) (2)
1 mol (142 g) 2 mol (2.98 g)
Theo phản ứng (1) : 4.31 g P tạo ra 2.142 g P2O5
a g P tạo ra \(\frac{{2.142.a}}{{4.31}} = 2,29.a\) (g) P2O5
Theo các phản ứng (1) và (2) :
4.31 (g) P tạo ra 4.98 (g) \({H_3}P{O_4}\)
a (g) P tạo ra \(\frac{{4.98.a}}{{4.31}} = 3,16.a\) (g) \({H_3}P{O_4}\)
Khối lượng \({H_3}P{O_4}\) có trong 500 ml dung dịch 85% :
\(\frac{{500.1,7.85}}{{100}}\) = 722,5 (g)
Khối lượng \({H_3}P{O_4}\) sau khi đã hoà tan P2O5 : 722,5 g + 3,16.a g
Khối lượng của dung dịch \({H_3}P{O_4}\) sau khi đã hoà tan P2O5 :
500.1,7 g + 2,29.a g = 850 g + 2,29.a g
Ta có phương trình về nồng độ phần trăm của dung dịch \({H_3}P{O_4}\) :
\(\frac{{(722,5 + 3,16.a).100\% }}{{850 + 2,29.a}}\) = 92,6%
Giải phương trình được a = 62,16 g photpho.

