Bài 9 Axit nitric và muối nitrat SBT Hóa lớp 11. Giải bài 2.25, 2.26, 2.27 trang 15, 16 . Câu 2.25: Có năm lọ không dán nhãn đựng riêng từng dung dịch của các chất sau đây…; Nhiệt phân hoàn toàn 27,3 g một hỗn hợp rắn X gồm NaNO3 và Cu(NO3)2, thu được hỗn hợp khí có thể tích 6,72 lít (đktc). Viết phương trình hoá học của các phản ứng xảy ra?
Bài 2.25: Có năm lọ không dán nhãn đựng riêng từng dung dịch của các chất sau đây : Al(NO3)3, \(N{H_4}N{O_3}\), AgNO3, FeCl3, KOH. Không được dùng thêm thuốc thử nào khác, hãy nêu cách nhận biết chất đựng trong mỗi lọ. Viết phương trình hoá học của các phản ứng đã được dùng để nhận biết.
Nhận biết được dung dịch FeCl3 do có màu vàng, các dung dịch còn lại đều không màu.
– Nhỏ dung dịch FeCl3 vào từng dung dịch trong ống nghiêm riêng. Nhận ra được dung dịch AgNO3 do xuất hiện kết tủa trắng AgCl và nhận ra được dung dịch KOH do tạo thành kết tủa Fe(OH)3 màu nâu đỏ :
FeCl3 + 3AgNO3 \( \to \) 3AgCl\( \downarrow \) + Fe(NO3)3
FeCl3 + 3KOH \( \to \) Fe(OH)3\( \downarrow \) + 3KCl
– Nhỏ từ từ dung dịch KOH vừa nhận biết được cho đến dư vào từng dung dịch còn lại là Al(NO3)3 và \(N{H_4}N{O_3}\) :
Ở dung dịch nào xuất hiện kết tủa keo màu trắng, sau đó kết tủa keo tan khi thêm dung dịch KOH, dung dịch đó là Al(NO3)3 :
Al(NO3)3 + 3KOH \( \to \) Al(OH)3\( \downarrow \) + 3KNO3
Al(OH)3 + KOH \( \to \) KAlO2(dd) + 2H2O
Ở dung dịch nào có khí mùi khai bay ra khi đun nóng nhẹ, dung dịch đó là \(N{H_4}N{O_3}\) :
Advertisements (Quảng cáo)
\(N{H_4}N{O_3}\) + KOH 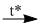 KNO3 + \(N{H_{3 \uparrow }}\) + H2O
KNO3 + \(N{H_{3 \uparrow }}\) + H2O
(mùi khai)
Bài 2.26: Để nhận biết ion \(N{O_3}^ – \) trong dung dịch, có thể dùng kim loại nhôm khử ion \(N{O_3}^ – \) trong môi trường kiềm. Khi đó phản ứng tạo ra ion aluminat \(Al{O_2}^ – \) và giải phóng khí amoniac. Hãy viết phương trình hoá học ở dạng ion rút gọn.
Phương trình hoá học ở dạng ion rút gọn :
8Al + 3\(N{O_3}^ – \) + 5\(O{H^ – }\) + 2H2O \( \to \) 8\(Al{O_2}^ – \) + 3\(N{H_3} \uparrow \)
Advertisements (Quảng cáo)
Bài 2.27: Nhiệt phân hoàn toàn 27,3 g một hỗn hợp rắn X gồm NaNO3 và Cu(NO3)2, thu được hỗn hợp khí có thể tích 6,72 lít (đktc).
1. Viết phương trình hoá học của các phản ứng xảy ra.
2. Tính thành phần % về khối lượng của mỗi muối trong hỗn hợp X.
1. Phương trình hoá học của các phản ứng :
2NaNO3 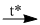 2NaNO2 + O2\( \uparrow \) (1)
2NaNO2 + O2\( \uparrow \) (1)
x mol 0,5x mol
2Cu(N03)2 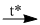 2CuO + 4NO2\( \uparrow \) + O2\( \uparrow \) (2)
2CuO + 4NO2\( \uparrow \) + O2\( \uparrow \) (2)
y mol y mol 2y mol 0,5y mol
2. Đặt X và y là số mol của NaNO3 và Cu(NO3)2 trong hỗn hợp X. Theo các phản ứng (1) và (2) số mol NO2 thu được là 2y mol và tổng số mol oxi là (0,5x + 0,5y) mol.
Biết khối lượng mol của hai chất NaNO3 và Cu(NO3)2 tương ứng là 85 và 188 (g/mol), ta có hệ phương trình :
85x + 188y = 27,3 (a)
0,5x + 2y + 0,5y = \(\frac{{6,72}}{{22,4}}\) = 0,3 (b)
Giải hệ phương trình (a), (b) được : x = y = 0,1.
Phần trăm khối lượng của mỗi muối trong hỗn hợp X :
\(\% {m_{NaN{O_3}}} = \frac{{85.0,1.100\% }}{{27,3}} = 31,1\% \)
\(\% {m_{Cu{{(N{O_3})}_2}}}\) = 100% – 31,1% = 68,9%

