Bài 8 Amoniac và muối amoni SBT Hóa lớp 11. Giải bài 2.14, 2.15, 2.16 trang 13, 14. Câu 2.14: Hoàn thành các phương trình hoá học sau đây…; Cho dung dịch Ba(OH)2 đến dư vào 75 ml dung dịch muối amoni sunfat, viết phương trình hoá học của phản ứng dưới dạng ion ?
Bài 2.14: Hoàn thành các phương trình hoá học sau đây :
1. ? + \(O{H^ – }\) \( \to \) NH3 + ?
2. (NH4)3PO4 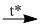 NH3 + ?
NH3 + ?
3. NH4Cl + NaNO2 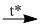 ? + ? + ?
? + ? + ?
4. (NH4)2Cr2O7 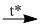 N2 + Cr2O3 + ?
N2 + Cr2O3 + ?
1. \(N{H_4}^ + \) + \(O{H^ – }\) \( \to \) NH3 + \({H_2}O\)
2. (NH4)3PO4 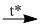 3NH3 + H3PO4
3NH3 + H3PO4
3. NH4Cl + NaNO2 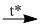 \({N_2} + NaCl + 2{H_2}O\)
\({N_2} + NaCl + 2{H_2}O\)
4. (NH4)2Cr2O7 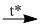 N2 + Cr2O3 + 4\({H_2}O\)
N2 + Cr2O3 + 4\({H_2}O\)
Bài 2.15: Chỉ được dùng một kim loại, hãy trình bày cách phân biệt các dung dịch muối sau đây : NH4NO3, (NH4)2SO4, K2SO4. Viết phương trình hoá học của các phản ứng xảy ra.
Advertisements (Quảng cáo)
Dùng kim loại bari để phân biệt các dung dịch muối : NH4NO3, (NH4)2SO4, K2SO4.
Lấy mỗi dung dịch một ít (khoảng 2-3 ml) vào từng ống nghiệm riêng. Thêm vào mỗi ống một mẩu nhỏ kim loại. Đầu tiên kim loại bari phản ứng với nước tạo thành Ba(OH)2, rồi Ba(OH)2 phản ứng với dung dịch muối.
– Ở ống nghiệm nào có khí mùi khai (NH3) thoát ra, ống nghiệm đó đựng dung dịch NH4NO3 :
\(2N{H_4}N{O_3} + Ba{(OH)_2} \to \)\(Ba{(N{O_3})_2} + 2N{H_{3 \uparrow }} + 2{H_2}O\)
– Ở ống nghiệm nào có kết tủa trắng (BaS04) xuất hiện, ống nghiệm đó đựng dung dịch K2SO4 :
Advertisements (Quảng cáo)
\({K_2}S{O_4} + Ba{(OH)_2} \to BaS{O_{4 \downarrow }} + 2KOH\)
– Ở ống nghiệm nào vừa có khí mùi khai (NH3) thoát ra, vừa có kết tủa trắng (BaS04) xuất hiện, ống nghiệm đó đựng dung dịch (NH4)2S04 :
\({(N{H_4})_2}S{O_4} + Ba{(OH)_2} \to \)\(BaS{O_{4 \downarrow }} + 2N{H_{3 \uparrow }} + 2{H_2}O\)
Bài 2.16: Cho dung dịch Ba(OH)2 đến dư vào 75 ml dung dịch muối amoni sunfat.
1. Viết phương trình hoá học của phản ứng dưới dạng ion.
2. Tính nồng độ mol của các ion trong dung dịch muối ban đầu, biết rằng phản ứng tạo ra 17,475 g một chất kết tủa. Bỏ qua sự thuỷ phân của ion amoni trong dung dịch.
1. \(2N{H_4}^ + + S{O_4}^{2 – } + B{a^{2 + }} + 2O{H^ – }\)\( \to BaS{O_{4 \downarrow }} + 2N{H_{3 \uparrow }} + 2{H_2}O\)
2. Số mol BaSO4 : \(\frac{{17,475}}{{233}}\) = 0,075(mol)
Theo phản ứng, vì lấy dư dung dịch Ba(OH)2 nên \(S{O_4}^{2 – }\) chuyển hết vào kết tủa BaSO4 và \(N{H_4}^ + \) chuyển thành NH3. Do đó :
\({n_{S{O_4}^{2 – }}} = {n_{BaS{O_4}}}\) = 0,075 mol ;
\({n_{N{H_4}^ + }} = 2.{n_{S{O_4}^{2 – }}}\) = 2.0,075 = 0,15 (mol).
Nồng độ mol của các ion \(N{H_4}^ + \) và \(S{O_4}^{2 – }\) trong 75 ml dung dịch muối amoni sunfat :
[\(N{H_4}^ + \)] = 2 (mol/l)
[\(S{O_4}^{2 – }\)] = 1 (mol/l)

