Bài 8 Amoniac và muối amoni SBT Hóa lớp 11. Giải bài 2.11, 2.12, 2.13 trang 13. Câu 2.11: Cho lượng khí amoniac đi từ từ qua ống sứ chứa 3,2 g CuO nung nóng đến khi phản ứng xảy ra hoàn toàn…; Nêu những điểm khác nhau về tính chất hoá học giữa muối amoni clorua và muối kali clorua ?
Bài 2.11: Cho lượng khí amoniac đi từ từ qua ống sứ chứa 3,2 g CuO nung nóng đến khi phản ứng xảy ra hoàn toàn, thu được chất rắn A và một hỗn hợp khí. Chất rắn A phản ứng vừa đủ với 20 ml dung dịch HCl 1M.
1. Viết phương trình hoá học của các phản ứng.
2. Tính thể tích khí nitơ (đktc) được tạo thành sau phản ứng.
1. Phương trình hoá học của các phản ứng :
\(2N{H_3} + 3CuO\) 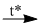 \({N_2} + 3Cu + 3{H_2}O\) (1)
\({N_2} + 3Cu + 3{H_2}O\) (1)
Chất rắn A thu được sau phản ứng gồm Cu và CuO còn dư. Chỉ có CuO phản ứng với dung dịch HCl :
CuO + 2HCl \( \to \) CuCl2 + H2O (2)
2. Số mol HCl phản ứng với CuO : nHCl = 0,02.1 = 0,02 (mol).
Advertisements (Quảng cáo)
Theo (2), số mol CuO dư : nCuO = \(\frac{1}{2}\)số mol HCl = \(\frac{0,02}{2}\) = 0,01 (mol).
Số mol CuO tham gia phản ứng (1) = số mol CuO ban đầu – số mol CuO dư = \(\frac{{3,2}}{{80}} – 0,01\) = 0,03 (mol).
Theo (1), số mol NH3 = \(\frac{2}{3}\)số mol CuO = \(\frac{2}{3}\).0,03 = 0,02 (mol) và số mol N2 = \(\frac{1}{3}\)số mol CuO = \(\frac{1}{3}\).0,03 = 0,01 (mol).
Thể tích khí nitơ tạo thành : 0,01.22,4 = 0,224 (lít) hay 224 ml.
Bài trắc nghiệm 2.12: Trong những nhận xét dưới đây về muối amoni, nhận xét nào đúng ?
Advertisements (Quảng cáo)
A. Muối amoni là chất tinh thể ion, phân tử gồm cation amoni và anion hiđroxit.
B. Tất cả các muối amoni đều dễ tan trong nước, khi tan phân li hoàn toàn thành cation amoni và anion gốc axit.
C. Dung dịch muối amoni tác dụng với dung dịch kiềm đặc, nóng cho thoát ra chất khí làm quỳ tím hoá đỏ.
D. Khi nhiệt phân muối amoni luôn luôn có khí amoniac thoát ra.
2.12. B
Bài 2.13: Nêu những điểm khác nhau về tính chất hoá học giữa muối amoni clorua và muối kali clorua. Viết các phương trình hoá học minh hoạ.
Điểm khác nhau về tính chất hoá học giữa muối amoni clorua và muối kali clorua :
– Muối amoni clorua phản ứng với dung dịch kiềm tạo ra khí amoniac, còn muối kali clorua không phản ứng với dung dịch kiềm:
\(N{H_4}Cl + NaOH\) 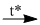 \(NaCl + N{H_{3 \uparrow }} + {H_2}O\)
\(NaCl + N{H_{3 \uparrow }} + {H_2}O\)
– Muối amoni clorua bị nhiệt phân huỷ, còn muối kali clorua không bị nhiệt phân huỷ :
\(N{H_4}C{l_{(r)}}\) 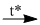 \(N{H_{3(k)}} + HC{l_{(k)}}\)
\(N{H_{3(k)}} + HC{l_{(k)}}\)

