Bài 1: Chất KClO4 có tên là gì?
A. Kali clorat B. Kali clorit
C. Kali hipoclorit D. Kali peclorat
Chọn D.
Bài 2: Đọc tên các hợp chất sau đây và cho biết số oxi hóa của clo trong từng hợp chất: Cl2O, KClO3, HClO, Cl2O3, CaCl2, HClO2, Cl2O7, Ca(ClO)2, HClO3, CaOCl2, Ca(ClO3)2.
\(\mathop {C{l_2}}\limits^{ – 1} O:\) điclo oxit
\(H\mathop {Cl}\limits^{ – 1} O:\) axit hipoclorơ
\(K\mathop {Cl}\limits^{ +5} {O_3}:\) kali clorat
\(\mathop {C{l_2}}\limits^{ + 3} {O_3}:\) điclo trioxit
\(Ca\mathop {C{l_2}}\limits^{ – 1} :\) canxi clorua
\(H\mathop {Cl}\limits^{ + 3} {O_2}:\) axit clorơ
\(\mathop {C{l_2}}\limits^{ + 7} {O_7}:\) điclo heptaoxit
Advertisements (Quảng cáo)
\(Ca{(\mathop {Cl}\limits^{ + 1} O)_2}:\) canxi hipoclorit
\(H\mathop {Cl}\limits^{ + 5} {O_3}:\) axit cloric
\(CaOC{l_2}:\;Ca\matrix{ / \cr \backslash \cr } \matrix{ {O – \mathop {Cl}\limits^{ + 1} } \cr {} \cr {} \cr {\mathop {Cl}\limits^{ – 1} \,\,\,\,} \cr } \) : Canxi clorua hipoclorit
\(Ca{(\mathop {Cl}\limits^{ + 5} {O_3})_2}:\) canxi clorat
Bài 3: Hãy cho biết tính chất hóa học quan trọng nhất của nước Gia-ven, clorua vôi và ứng dụng của chúng. Vì sao clorua vôi được sử dụng nhiều hơn nước Gia-ven ?
– Tính chất hóa học quan trọng nhất của nước Gia-ven, clorua vôi là tính oxi hóa mạnh.
– Ứng dụng chủ yếu của nước Gia-ven, clorua vôi là tẩy trắng vải sợi, giấy, sát trùng, tẩy uế,…
Advertisements (Quảng cáo)
– Clorua vôi được sử dụng nhiều hơn nước Gia-ven là do clorua vôi có hàm lượng hipoclorit cao hơn, dễ bảo quản và dễ chuyên chở hơn.
Bài 4: Cho các hóa chất NaCl(r), MnO2(r), NaOH(dd), KOH(dd), H2SO4(dd đặc), Ca(OH)2(r). Từ các hóa chất đó, có thể điều chế được các chất dau đây hay không?
a) Nước Gia-ven
b) Kali clorat
c) Clorua vôi
d) Oxi
e) Lưu huỳnh đioxit
a) Nước Gia-ven:
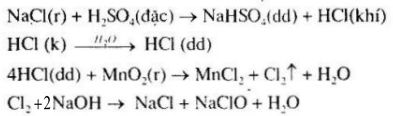
b) Kali clorat: \(3C{l_2} + 6KOH\left( {dd} \right)\buildrel {{{100}^0}C} \over \longrightarrow 5KCl + KCl{O_3} + 3{H_2}O\)
c) Clorua vôi: \(C{l_2}\,\left( k \right) + Ca{\left( {OH} \right)_2}\,\left( r \right)\,\buildrel {{{30}^0}C} \over \longrightarrow CaOC{l_2} + {H_2}O\)
d) Oxi: \(2KCl{O_3}\,\buildrel {Mn{O_2},{t^0}} \over \longrightarrow 2KCl + 3{O_2}\)
e) Lưu huỳnh đioxit: Các hóa chất đã cho không đủ để điều chế SO2.
Bài 5: Để điều chế kali clorat với giá hạ thành, người ta thường làm như sau: Cho khí clo đi qua nước vôi đun nóng, lấy dung dịch thu được trộn với KCl và làm lạnh. Khi đó kali clorat sẽ kết tinh.
Hãy viết phương trình hóa học của các phản ứng xảy ra và giải thích vì sao kali clorat kết tinh.
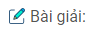
Các phản ứng xảy ra:
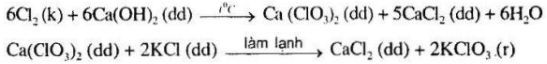
\(KCl{O_3}\) có độ tan nhỏ hơn CaCl2 nên kết tinh.

