Bài 1: Trong các dãy chất dưới đây, dãy nào gồm toàn các chất có thể tác dụng với clo ?
A. Na, H2, N2;
B. NaOH(dd), NaBr(dd), NaI (dd);
C. KOH(dd), H2O, KF(dd);
D. Fe, K, O2.
Chọn B. Dãy chất tác dụng với clo là:
\(\eqalign{ & C{l_2} + 2NaOH\,\, \to \,\,NaCl + NaClO + {H_2}O \cr & C{l_2} + 2NaBr\,\,\, \to \,\,2NaCl + B{r_2} \cr & C{l_2} + 2NaI\,\, \to \,\,2NaCl + {I_2} \cr} \)
Bài 2: Viết phương trình hóa học thực hiện các biến hóa:
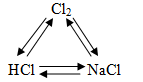
Các phản ứng xảy ra:
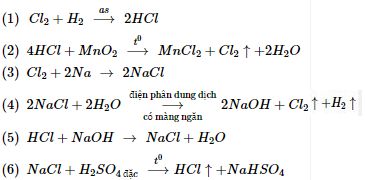
Bài 3: Người ta có thể điều chế KCl bằng:
a) một phản ứng hóa hợp.
b) một phản ứng phân hủy.
c) một phản ứng trao đổi.
d) một phản ứng thế.
1. Hãy dẫn ra phản ứng cho mỗi trường hợp trên.
2. Trường hợp nào là phản ứng oxi hóa – khử? Trong đó số oxi hóa của clo thay đổi như thế nào?
Advertisements (Quảng cáo)
1) Các phản ứng điều chế KCl
Một phản ứng hóa hợp:
\(2\mathop K\limits^0 + \mathop {C{l_2}}\limits^0 \,\, \to \,\,2\mathop K\limits^{ + 1} \mathop {Cl}\limits^{ – 1} \) (1)
Một phản ứng phân hủy:
\(2K\mathop {Cl}\limits^{ + 5} \mathop {{O_3}}\limits^{ – 2} \,\buildrel {Mn{O_2},{t^0}} \over \longrightarrow 2K\mathop {Cl}\limits^{ – 1} + 3\mathop {{O_2}}\limits^0 \uparrow \) (2)
Một phản ứng trao đổi:
\(\mathop {{K_2}}\limits^{ + 1} S{O_4} + \mathop {Ba}\limits^{ + 2} \mathop {C{l_2}}\limits^{ – 1} \,\, \to \,\,\mathop {Ba}\limits^{ + 2} S{O_4} \downarrow + 2\mathop K\limits^{ + 1} \mathop {Cl}\limits^{ – 1} \) (3)
Một phản ứng thế:
\(2\mathop K\limits^0 + 2\mathop H\limits^{ + 1} \mathop {Cl}\limits^{ – 1} \,\, \to \,\,2\mathop K\limits^{ + 1} \mathop {Cl}\limits^{ – 1} + \mathop {{H_2}}\limits^0 \uparrow \,\,\) (4)
2) Các phản ứng (1), (2) và (4) là phản ứng oxi hóa – khử.
Trong (1): Số oxi hóa của clo giảm từ 0 xuống – 1.
Trong (2): Số oxi hóa của clo giảm từ +5 xuống – 1.
Trong (3), (4): Số oxi hóa của clo không thay đổi.
Advertisements (Quảng cáo)
Bài 4: Viết phương trình hóa học của phản ứng thực hiện các biến hóa dưới đây, ghi tên các chất và điều kiện của phản ứng.
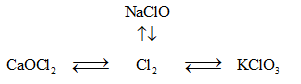
Các phản ứng xảy ra:
\(\eqalign{ & \left( 1 \right)\,\,NaClO + 2HCl\,\, \to \,\,NaCl + C{l_2} + {H_2}O \cr & \left( 2 \right)\,\,C{l_2} + 2NaOH\,\, \to \,\,NaCl + NaClO + {H_2}O \cr & \left( 3 \right)\,\,C{l_2} + Ca{\left( {OH} \right)_{2\,rắn}}\,\, \to \,\,CaOC{l_2} + {H_2}O \cr & \left( 4 \right)\,\,CaOC{l_2} + 2HCl\,\, \to \,\,CaC{l_2} + C{l_2} \uparrow + {H_2}O \cr & \left( 5 \right)\,\,KCl{O_3} + 6HCl\, \to \,\,3C{l_2} + KCl + 3{H_2}O \cr & \left( 6 \right)\,\,3C{l_2} + 6KOH\,\,\buildrel {{{100}^0}C} \over \longrightarrow 5KCl + KCl{O_3} + 3{H_2}O \cr} \)
Tên các chất:
– NaClO: Natri hipoclorit.
– CaOCl2: Canxi clorua hipoclorit.
– KClO: Kali clorat
– NaBrO: Natri hipobromit.
Bài 5: Hỗn hợp khí A gồm clo và oxi. A phản ứng vừa hết với một hỗn hợp gồm 4,80 g magie và 8,10 g nhôm tạo ra 37,05 g hỗn hợp các muối clorua và oxit của hai kim loại.
Xác định thành phần phần trăm theo khối lượng và theo thể tích của hỗn hợp A.
\({n_{Al}} = {{8,1} \over {27}} = 0,3\,\,\left( {mol} \right),\,\,{n_{Mg}} = {{4,8} \over {24}} = 0,2\,\left( {mol} \right).\) Đặt số mol O2 và Cl2 cần dùng lần lượt là a mol và b mol.

\(\sum {{n_{e\,nhường}}} = \sum {{n_{e\,nhận}}} \Rightarrow 1,3 = 4a + 2b\,\,\,\left( * \right)\)
Áp dụng định luật bảo toàn khối lượng ta có:
\({m_{Al}} + {m_{Mg}} + {m_{{O_2}}} + {m_{C{l_2}}} = {m_Z}\)
\(\Rightarrow 8,1 + 4,8 + 32a + 71b = 37,05\,\,\left( {**} \right)\)
Từ (*) và (**), ta được \(\left\{ \matrix{ a = 0,2 \hfill \cr b = 0,25 \hfill \cr} \right.\)
Thành phần phần trăm về thể tích của mỗi khí trong hỗn hợp A:
\(\% {V_{{O_2}}} = \% {n_{{O_2}}} = {{0,2.100\% } \over {\left( {0,2 + 0,25} \right)}} = 44,44\%\)
\(\% {V_{C{l_2}}} = \% {n_{C{l_2}}} = 100\% – 44,44\% = 55,56\% \)
Thành phần phần trăm về khối lượng của mỗi khí trong hỗn hợp A:
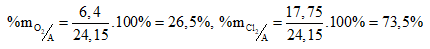
Bài 6: Muối ăn bị lẫn các tạp chất là Na2SO4, MgCl2, CaCl2 và CaSO4. Hãy trình bày phương pháp hóa học để loại bỏ các tạp chất, thu được NaCl tinh khiết. Viết phương trình hóa học các phản ứng.
– Cho dung dịch \(N{a_2}C{O_3}\) vừa đủ vào dung dịch muối ăn có lẫn tạp chất Na2SO4, MgCl2, CaCl2, CaSO4 để loại bỏ các ion Mg2+, Ca2+.
\(\eqalign{ & N{a_2}C{O_3} + MgC{l_2}\,\, \to \,\,MgC{O_3} \downarrow + 2NaCl \cr & N{a_2}C{O_3} + CaC{l_2}\,\, \to \,\,CaC{O_3} \downarrow + 2NaCl \cr & N{a_2}C{O_3} + CaC{O_3}\,\, \to \,\,CaC{O_3} \downarrow + N{a_2}S{O_4} \cr} \)
– Lọc bỏ kết tủa sau đó cho dung dịch BaCl2 vào dung dịch nước lọc để ion \(SO_4^{2 – }\).
\(BaC{l_2} + N{a_2}S{O_4}\,\, \to \,\,BaS{O_4} \downarrow + 2NaCl\)
– Lọc bỏ kết tủa \(BaS{O_4}\), cho dung dịch \(N{a_2}C{O_3}\) vào dung dịch nước lọc (nếu còn dư \(BaC{l_2}\) ) để loại bỏ ion \(B{a^{2 + }}\).
\(BaC{l_2} + N{a_2}C{O_3}\,\, \to \,\,BaC{O_3} \downarrow + 2NaCl\)
– Lọc bỏ kết tủa \(BaC{O_3}\), cho dung dịch HCl vào dung dịch nước lọc (nếu còn dư \(N{a_2}C{O_3}\)) và đun nhẹ được NaCl tinh khiết.

