Bài 8.32: Chất A là một ancol no, đơn chức, mạch hở. Đun m gam A với H2S04 đặc ở 170°C thu được 17,85 gam anken (hiệu suất 85%). Cũng m gam A khi tác dụng với HBr tạo ra 36,9 gam dẫn xuất brom (hiệu suất 60%).
1. Xác định công thức phân tử, công thức cấu tạo và tên của ancol A.
2. Tính giá trị m.
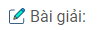
1. Nếu hiệu suất các phản ứng là 100% thì :
– Khối lượng anken thu được là : \(\frac{{17,85.100}}{{85}}\) = 21(g).
– Khối lương dẫn xuất brom thu đươc là : \(\frac{{36,9.100}}{{60}}\) = 61,5(g)
\({C_n}{H_{2n + 1}}OH\) 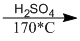 \({C_n}{H_{2n}} + {H_2}O\)
\({C_n}{H_{2n}} + {H_2}O\)
x mol x mol
\({C_n}{H_{2n + 1}}OH + HB{\rm{r}} \to {C_n}{H_{2n + 1}}B{\rm{r}} + {H_2}O\)
x mol x mol
14nx = 21 ; (14n + 81)x = 61,5
\( \Rightarrow \) x = 0,5 ; n = 3.
Ancol A có CTPT C3H8O và có CTCT
CH3 – CH2 – CH2 – OH ( propan-1-ol ) hoặc 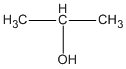 ( propan-2-ol )
( propan-2-ol )
2. m = 0,5.60 = 30 (g)
Bài 8.33: Chất A là một ancol có mạch cacbon không phân nhánh. Đốt cháy hoàn toàn m gam A, người ta thu được 2,24 lít C02 (đktc) và 2,25 g H20. Mặt khác, nếu cho 18,55 g A tác dụng hết với natri, thu được 5,88 lít H2 (đktc).
1. Hãy xác định công thức phân tử, công thức cấu tạo và tên của chất A.
2. Tính giá trị m.
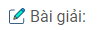
1. Số mol \(C{O_2}\) = \(\frac{{2,24}}{{22,4}}\) = 0,1 (mol).
Số mol H20 = \(\frac{{2,25}}{{18}}\) =0,125 (mol).
Khi đốt ancol A, số mol H20 tạo thành > số mol C02. Vậy, A phải là ancol no, mạch hở. A có dạng CnH2n+2-x(OH)x hay CnH2n+2Ox.
\({C_n}{H_{2n + 2}}{O_x} + \frac{{3n + 1 – x}}{2}{O_2} \to nC{O_2} + (n + 1){H_2}O\)
Theo đầu bài ta có : \(\frac{n}{{n + 1}} = \frac{{0,1}}{{0,125}}\) \( \Rightarrow \) n = 4.
\({C_4}{H_{10 – x}}{(OH)_x} + xNa \to {C_4}{H_{10 – x}}{(ONa)_x} + \frac{x}{2}{H_2}O\)
Theo phương trình : Cứ (58 + 16x) g A tạo ra 0,5000x mol H2.
Advertisements (Quảng cáo)
Theo đầu bài : Cứ 18,55 g A tạo ra \(\frac{{5,88}}{{22,4}}\) = 0,2625 mol H2.
\( \Rightarrow \frac{{58 + 16{\rm{x}}}}{{18,55}} = \frac{{0,5{\rm{x}}}}{{0,2625}} \Rightarrow x = 3\)
CTPT của A là C4H10O3.
Theo đầu bài A có mạch cacbon không nhánh ; như vậy các CTCT thích hợp là
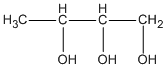 butan-1,2,3 triol
butan-1,2,3 triol
và 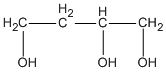 butan-1,2,4-triol.
butan-1,2,4-triol.
2. Để tạo ra 0,1 mol C02 ; số mol A cần đốt là : \(\frac{{0,1}}{4}\) = 0,025 (mol).
Như vậy : m = 0,025.106 = 2,65 (g).
Bài 8.34: Một bình kín dung tích 5,6 lít có chứa hỗn hợp hơi của hai ancol đơn chức và 3,2 g 02. Nhiệt độ trong bình là 109,2°C, áp suất trong bình là 0,728 atm.
Bật tia lửa điện để đốt cháy hoàn toàn hai ancol, sau phản ứng nhiệt độ trong bình là 136,5°C và áp suất là p atm.
Dẫn các chất trong bình sau phản ứng qua bình (1) đựng H2S04 đặc (dư), sau đó qua bình (2) đựng dung dịch NaOH (dư), thấy khối lượng bình (1) tăng 1,26 g, khối lượng bình (2) tăng 2,2 g.
1. Tính p, biết rằng thể tích bình không đổi.
2. Xác định công thức phân tử, công thức cấu tạo, phần trăm khối lượng và gọi tên từng chất trong hỗn hợp ancol biết rằng số mol của ancol có phân tử khối nhỏ hn gấp 2 lần số mol của ancol có phân tử khối lớn hơn.
1. Đổi thể tích hỗn hợp khí trong bình trước phản ứng về đktc :
\({V_o} = \frac{{{p_1}{V_1}}}{{{T_1}}}.\frac{{{T_o}}}{{{p_o}}} = \frac{{0,728.5,6}}{{273 + 109,2}}.\frac{{273}}{1}\) = 2,912 (lít)
Số mol các chất trong bình trước phản ứng là : \(\frac{{2,912}}{{22,4}}\) = 0,13 (mol).
Số mol 02 = \(\frac{{3,2}}{{32}}\) = 0,1 (mol) \( \Rightarrow \) Số mol 2 ancol = 0,13 – 0,1 = 0,03 (mol).
Advertisements (Quảng cáo)
Khi 2 ancol cháy :
\(\begin{array}{l}
{C_x}{H_y}O + (x + \frac{y}{4} – \frac{1}{2}){O_2} \to xC{O_2} + \frac{y}{2}{H_2}O\\
{C_{x’}}{H_{y’}}O + (x’ + \frac{{y’}}{4} – \frac{1}{2}){O_2} \to x’C{O_2} + \frac{{y’}}{2}{H_2}O\\
{H_2}S{O_4} + n{H_2}O \to {H_2}S{O_4}.n{H_2}O\\
2NaOH + C{O_2} \to N{a_2}C{O_3} + {H_2}O
\end{array}\)
Số mol H20 là : \(\frac{{1,26}}{{18}}\) = 0,07 (mol) ;
Số mol \(C{O_2}\) là : \(\frac{{2,2}}{{44}}\) = 0,05 (mol).
Theo định luật bảo toàn khối lượng :
\({m_{{O_2}du}} = {m_{{O_2}ban{\rm{d}}au}} + {m_{Ot{\rm{r}}ong{\rm{a}}ncol}} – {m_{Ot{\rm{r}}ong{H_2}O}} – {m_{Ot{\rm{r}}ongC{O_2}}}\)
= 3,2 + 0,03.16 – 0,07.16 – 0,05.32 = 0,96 (g).
Số mol 02 còn dư : \(\frac{{0,96}}{{32}}\) = 0,03 (mol).
Tổng số mol các chất trong bình sau phản ứng :
0,07 + 0,05 + 0,03 = 0,15 (mol).
Thể tích của 0,15 mol khí ở đktc là : V0 = 0,15.22,4 = 3,36 (lít).
Thực tế, sau phản ứng V = 5,6 lít.
\(\frac{{pV}}{T} = \frac{{{P_o}V{‘_o}}}{{{T_o}}} \Rightarrow p = \frac{{{P_o}V{‘_o}}}{{{T_o}}}.\frac{T}{V} = \frac{{1.3,36}}{{273}}.\frac{{(273 + 136,5)}}{{5,6}} = 0,9(atm)\)
2. Giả sử CxHyO có PTK nhỏ hơn Cx’Hy’O ; như vậy số mol CxHyO sẽ là 02 và số mol Cx’Hy’O là 0,01.
Số mol C02 sẽ là 0,02x + 0,01x’ = 0,05 (mol) hay 2x + x’ = 5.
x và x’ là số nguyên : x = 1 ; x’ = 3
hoặc x = 2 ; x’ = 1
Cặp x = 2 ; x’ = 1 loại vì trái với điều kiện : CxHyO có PTK nhỏ hơn Cx’Hy’O
Vậy, một ancol là \(C{H_4}O\) và chất còn lại \({C_3}{H_{y’}}O\).
Số mol H20 là 0,02.2 + 0,01.\(\frac{{y’}}{2}\) = 0,07 (mol).
\( \Rightarrow \) y’ = 6 \( \Rightarrow \) Ancol còn lại là C3H60.
% về khối lượng của \(C{H_4}O\) hay CH3 – OH (ancol metylic) :
\(\frac{{0,02.32}}{{0,02.32 + 0,01.58}}\).100% = 52,46%.
% về khối lượng của C3H60 hay CH2 = CH – CH2 – OH (ancol anlylic) : 100,00% – 52,46% = 47,54%.
Bài 8.35: Chất A là một ancol no mạch hở. Đốt cháy hoàn toàn 9,50 g chất A, thu được 8,40 lít C02. Mặt khác nếu cho 11,40 g chất A tác dụng với Na (lấy dư) thì thu được 3,36 lít H2. Các thể tích ở đktc. Xác định công thức phân tử, công thức cấu tạo và tên chất A.
Chất A là CnH2n+2–x(OH)x hay CnH2n+2Ox
\({C_n}{H_{2n + 2}}{O_x} + {{3n + 1 – x} \over 2}{O_2} \to nC{O_2} + (n + 1){H_2}O\)
Theo phương trình : Cứ (14n + 16x + 2) g A tạo ra n mol C02
Theo đầu bài : Cứ 9,5 g A tạo ra \({{8,4} \over {22,4}}\) mol C02
vậy \({{14n + 16x + 2} \over {9,5}} = {n \over {0,375}}\) (1)
2CnH2n+2-x(OH)x + 2xNa→ 2CnH2n+2-x(ONa)x + xH2
Theo phương trình : Cứ 2(14n + 16x + 2) g A tạo ra x mol H2
Theo đầu bài : Cứ 11,40 g A tạo ra \({{3,36} \over {22,4}}\) mol H2
vậy \({{2.(14n + 16x + 2)} \over {11,4}} = {x \over {0,15}}\) (2)
Giải hệ phương trình (1) và (2) tìm được x = 2 ; n = 3.
Công thức phân tử chất A : C3H802.
Công thức cấu tạo chất A : CH2-CH-CH3
| |
OH OH Propan-1,2-điol
CH 2-CH 2 — CH 2
| |
OH OH Propan-1,3-điol

