Bài 5.70: Vì sao người ta có thể điều chế \(Cl_2, Br_2, I_2\) bằng cách cho hỗn hợp dung dịch \(H_2SO_4\) đặc và \(MnO_2\) tác dụng với muối clorua, bromua, iotua nhưng không thể áp dụng phương pháp này để điều chế \(F_2\) ? Bằng cách nào có thể điều chế được \(F_2\) ? Viết PTHH của các phản ứng.
Người ta có thể điều chế \(Cl_2 ; Br_2 ; I_2\) bằng oách cho hỗn hợp \(H_2SO_4\) và \(MnO_2\) tác dụng với muối clorua, bromua, iotua. Các sản phẩm trung gian là HCL, HBr, HI bị hỗn hợp (\(MnO_2 + H_2SO_4\)) oxi hoá thành \(Cl_2 ; Br_2 ; I_2\) .Các PTHH có thể viết như sau :
\(NaCl + H_2SO_4 →NaHSO_4 + HCL\)
\(MnO_2 + 4HCL →MnCl_2 + Cl_2↑ + 2H_2O\)
Các phản ứng cũng xảy ra tương tự đối với muối NaBr và NaI.
Không thể áp dụng phương pháp trên để điều chế \(F_2\) vì hỗn hợp oxi hoá (\(MnO_2 + H_2SO_4\)) không đủ mạnh để oxi hoá HF thành \(F_2\).
Cách duy nhất điều chế \(F_2\) là điện phân KF tan trong HF lỏng khan (không
có mặt \(H_2O\)). Dùng dòng điện một chiểu 8-12 von ; 4000 – 6000 ampe ; Bình điện phân có catôt làm bằng thép đặc biệt hoặc bằng đồng và anôt làm bằng than chì (graphit).
Ở catôt : \(2H^+ + 2e → H_2\)
ở anôt : \(2F^- → F_2 + 2e\)
Bài 5.71: Bằng phương pháp hoá học nào có thể
a) Xác định được có khí clo lẫn trong khí hiđro clorua ?
b) Thu được khí clo từ hỗn hợp khí ở câu a ?
c) Thu được khí hiđro clorua từ hỗn hợp khí ở câu a ?
Viết PTHH của các phản ứng xảy ra.
a) Cách 1 : Cho hỗn hợp khí đi qua dung dịch HBr hoặc dung dịch \(HI, Cl_2 \) sẽ oxi hoá HBr hoặc HI thành \(Br_2\) hoặc \(I_2\) làm cho dung dịch không màu ban đầu chuyển thành màu vàng hoặc màu nâu.
\(Cl_2 + 2HBr → 2HCL + Br_2\) (dung dịch có màu vàng)
hoặc \(Cl_2 + 2HI → 2HCL + I_2\) (dung dịch có màu vàng nâu)
Cách 2 : Có thể nhận biết hỗn hợp khí bằng giấy quỳ tím ẩm. Lúc đầu quỳ tím chuyển thành màu đỏ, do hỗn hợp khí có HCl. Sau đó màu đỏ biến mất do trong hồn hợp có khí \(Cl_2\). Khí \(Cl_2\) tác dụng với \(H_2O\) sinh ra HClO có tính oxi hoá rất mạnh, làm mất màu đỏ :
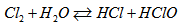
b) Cho hỗn hợp khí trên (HCL và \(Cl_2\)) tác dụng với chất oxi hoá mạnh là \(MnO_2\), dung dịch \(KMnO_4\)… HCL bị oxi hoá thành \(Cl_2\), kết quả thu được chất khí duy nhất là \(Cl_2\).
\(4HCL + MnO_2 → MnCl_2 + Cl_2 + 2H_2O\)
Advertisements (Quảng cáo)
\(16HCL + 2KMnO_4 → 2KC1 + 2MnCl_2 + 5C1_2 + 8H_2O\)
c) Cho hỗn hợp khí trên tác dụng với H2 ở nhiệt độ cao, thu được khí duy nhất là HCL :
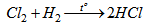
Hoặc cho hỗn hợp khí đi qua ống đựng bột đồng kim loại đun nóng, khí \(Cl_2\) tác dụng với đồng kim loại tạo muối clorua là chất rắn. Chất khí không tác dụng với đồng kim loại là HCL, nên chất khí đi ra chỉ là HCL.
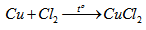
Bài 5.72: Có 4 lọ không có nhãn đựng riêng biệt các muối : KF, KCl, KBr, KI.
Hãy cho biết :
a) Cách phân biệt muối đựng trong mỗi lọ bằng phương pháp hoá học.
b) Từ những muối đã cho điều chế các halogen tương ứng và các hiđro halogenua tương ứng.
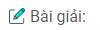
a) Lấy một ít muối trong mỗi lọ đem hoà tan vào nước được các dung dịch riêng biệt.
Dung dịch nào tác dụng được với \(Br_2\) hoặc nước brom tạo ra tinh thể có màu đen tím, đó là dung dịch KI.
\(Br_2 + 2KI → 2KBr + I_2\)
Những dung dịch còn lại, dung dịch nào tác dụng được với \(Cl_2\) tạo ra dung dịch có màu vàng nâu (màu của\( Br_2\) tan trong nước), đó là dung dịch KBr.
\(Cl_2 + 2KBr → 2KC1 + Br_2\)
Advertisements (Quảng cáo)
Hai dung dịch còn lại là KF và KC1 : cho tác dụng với dung dịch AgNO_3, dung dịch nào tạo kết tủa trắng, đó là dung dịch KC1.
\(KCl + AgNO_3 → AgCl↓ + KNO_3\)
Dung dịch còn lại là KF.
b) Điều chế halogen tương ứng từ muối đã cho :
Điều chế \(F_2\) : Điện phân mưối KF tan trong chất lỏng HF khan thu được \(F_2\) ở anôt.
Điều chế \(Cl_2\) : Điện phân dung dịch KC1 trong nước, có màng ngăn.
Điều chế \(Br_2\) : Cho \(H_2SO_4\) đặc tác dụng với hỗn hợp rắn là KBr và \(MnO_2\), đun nóng. Các phản ứng xảy ra như sau :
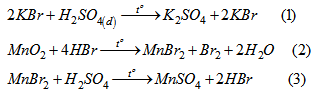
Phản ứng tổng của (1), (2), (3) là :
\(2KBr + MnO_2 + 2H_2SO_4 \buildrel {{t^o}} \over \longrightarrow K2SO_4 + MnSO_4 + Br_2 + 2H_2O\) (4)
Điều chế \(I_2\) tương tự điểu chế \(Br_2\) và có phản ứng tổng là :
\(2KI + MnO_2 + 2H_2SO_4 \buildrel {{t^o}} \over \longrightarrow K2SO_4 + MnSO_4 + I_2 + 2H_2O\)
– Điều chế các hiđro halogenua từ các muối tương ứng :
– Điều chế HF : \(KF + H_2SO_4\buildrel {{t^o}} \over \longrightarrow KHSO_4 + HF↑\)
– Điều chế HCL : \(KCl + H_2SO_4\buildrel {{t^o}} \over \longrightarrow KHSO_4 + HCl↑\)
Điều chế HBr : Điện phân dung dịch KBr có màng ngăn (hoặc cho \(Cl_2\) tác dụng với dung dịch KBr, hoặc cho muối KBr tác dụng với hỗn hợp \(MnO_2\) và \(H_2SO_4\) đặc) được \(Br_2\), sau đó cho \(Br_2\) tác dụng với \(H_2\) ở nhiệt độ cao được HBr.
\(H_2 + Br_2 \buildrel {{t^o}} \over \longrightarrow 2HBr\)
Điều chế HI : Tương tự như điều chế HBr ở trên hoặc từ \(I_2\) ta điều chế HI bằng cách dùng khí \(H_2S\) khử \(I_2\).
\(I_2 + H_2S \buildrel {{t^o}} \over \longrightarrow 2HI + S↓\)
Bài 5.73: Tính khối lượng muối NaCl và muối NaI cần thiết để có 10 tấn muối ăn chứa 2,5% NaI.
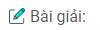
Một tấn muối ăn chứa 0,025 tấn NaI →
Khối lượng NaI =0,25 tấn
Khối lượng NaCl = 9,75 tấn.
Bài 5.74: Cho các chất sau : \(KC1, CaCl_2, MnO_2\), dung dịch \(H_2SO_4\) đặc. Đem trộn 2 hoặc 3 chất với nhau. Trộn như thế nào thì tạo thành clo ? Trộn như thế nào thì tạo thành hiđro clorua ? Viết PTHH của các phản ứng.
+ Để tạo thành clo thì trộn KC1 hoặc \(CaCl_2\) với \(MnO_2\) và \(H_2SO_4\) đặc.
\(2KC1 + H_2SO_4 (đặc) \buildrel {{t^o}} \over \longrightarrow K_2SO_4 + 2HCl↑ \)
\(MnO_2 + 4HCL \buildrel {{t^o}} \over \longrightarrow MnCl_2 + Cl_2 + 2H_2O\)
+ Để tạo thành hiđro clorua thì trộn KCl hoặc CaClO với \(H_2SO_4\) đặc.
\(CaCl_2 + 2H_2SO_4(đặc) \buildrel {{t^o}} \over \longrightarrow Ca(HSO_4)_2 + 2HCl↑ \)
Bài 5.75: Dựa vào cấu tạo, hãy giải thích vì sao tính oxi hoá của ion hipoclorit \(ClO^-\) mạnh hơn ion clorat \(ClO_3^-\). Lấy thí dụ phản ứng để minh hoạ.
 \(ClO^-\) và \(ClO_3^-\) có cấu tạo tương ứng như sau :
\(ClO^-\) và \(ClO_3^-\) có cấu tạo tương ứng như sau :
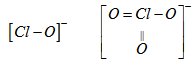
Liên kết Cl-O trong \(ClO_3^-\) ngắn hơn trong \(ClO^-\) nên độ bền \(ClO_3^-\) > \(ClO^-\). Do đó tính oxi hoá \(ClO_3^-\) < \(ClO^-\).
Trong dung dịch nước, ion \(ClO_3^-\) chỉ oxi hoá trong môi trường axit mạnh, còn ion \(ClO^-\) oxi hoá trong bất kì môi trường nào.
Thí dụ : \(NaClO + 2KI + H_2O → NaCl + I_2 + 2KOH\)
\(NaClO_3 + 6KI + 3H_2SO_4 → NaCl + 3I_2 + 3K_2SO_4 + 3H_2O\)

