Bài 4.31: Cho hỗn hợp X gồm AI và Mg tác dụng vừa đủ với 1,344 lít (đktc) hỗn hợp khí Y gồm \(O_2\) và \(Cl_2\), \(d_Y/H_2\)=27,375 . Sau phản ứng thu được 5,055 gam chất rắn. Tính khối lượng của Al và Mg trong hỗn hợp ban đầu.
– Từ giả thiết tính được : \({n_{C{l_2}}} = 0,035mol; {n_{{O_2}}} = 0,025mol\)
Theo ĐLBT khối lượng :
\(\begin{array}{l}
{m_{C{l_2}}} + {m_{{O_2}}} + {m_{Al}} + {m_{Mg}} = 5,055 \Rightarrow {m_{Al}} + {m_{Mg}} = 5,055 – 3,285 = 1,77gam\\
– \left. \begin{array}{l}
Mg \to M{g^{2 + }} + 2{\rm{e}}\\
x\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,2{\rm{x}}\\
Al \to A{l^{3 + }} + 3{\rm{e}}\\
y\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,3y
\end{array} \right\};\\
\left. \begin{array}{l}
C{l_2}\,\,\,\,\,\,\,\, + \,\,\,\,\,2{\rm{e}} \to 2C{l^ – }\\
0,035\,\,\,\,\,\,0,07\,\,\,\,\,\left( {mol} \right)\\
{O_2}\,\,\,\,\,\,\,\, + \,\,\,\,\,\,4e \to 2{O^{2 – }}\\
0.025\,\,\,\,\,\,\,\,\,0,1\,\,\,\,\,\,\,\left( {mol} \right)
\end{array} \right\}2{\rm{x}} + 3y = 0,17\,\,(3)
\end{array}\)
Từ (3) và (4)
\( \Rightarrow \left\{ \begin{array}{l}
x = 0,04\\
y = 0,03
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
{m_{Mg}} = 0,04 \times 24 = 0,96\,(gam)\\
{m_{Al}} = 0,03 \times 27 = 0,81\,(gam)
\end{array} \right.\)
Phản ứng không oxi hoá – khử
Bài 4.32: Sục hết V lít khí \(CO_2\) (đktc) vào 100 ml dung dịch chứa NaOH 2M và \(Na_2CO_3\) 1M, sau phản ứng thu được dung dịch chứa 24,3 gam chất tan. Xác định giá trị của V.
Khi sục khí \(CO_2\) vào dung dịch chứa NaOH, \(Na_2CO_3\) thì dung dịch thu được sau phản ứng chỉ có 2 trường hợp :
Advertisements (Quảng cáo)
Trường hợp 1: Dung dịch thu được chứa \(NaHCO_3\) (x mol) và \(Na_2CO_3\) (y mol).
+ Khối lượng hỗn hợp : 84x + 106y = 24,3 (1)
+ ĐLBTKL áp dụng với Na : x + 2y = 2.0,1 + 2.1.0,1 = 0,4 (2)
) + ĐLBTKL áp dụng với C : \({V \over {22,4}}\) + 1.0,1 = x + y (3)
Giải hệ (1), (2), (3) được V = 3,36 lít.
Trường hợp 2 : Dung dịch thu được chứa NaOH (a mol) và \(Na_2CO_3\) (b mol)
Advertisements (Quảng cáo)
+ Khối lượng hỗn hợp : 40a + 106b = 24,3 (4)
+ ĐLBTKL áp dụng với Na : a + 2b = 0,4 (5)
+ ĐLBTKL áp dụng với C: \({V \over {22,4}}\)+0,1=b (6)
Giải hệ (4), (5) và (6) thấy không có nghiệm.
Bài 4.33: Cho 3,164 gam hỗn hợp 2 muối \(CaCO_3\) và \(BaCO_3\) tác dụng với dung dịch HC1 dư, thu được 448 ml khí \(CO_2\) (đktc). Tính thành phần % số mol của \(BaCO_3\) trong hỗn hợp.
\({n_{C{O_2}}} = {{0,448} \over {22,4}} = 0,O_2\,\left( {mol} \right) \to \overline M = {{3,164} \over {0,O_2}} = 158,2\left( {g/mol} \right)\)
Áp dụng sơ đồ đường chéo:
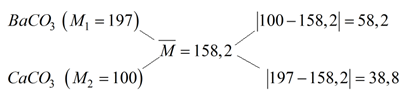
\( \Rightarrow \% {n_{BaC{O_3}}} = {{58,2} \over {58,2 + 38,8}} \times 100\% = 60\% \)
Bài 4.34: Cho 4 gam hỗn hợp \(MCO_3\) và \(M’ CO_3\) vào dung dịch HC1 dư thấy thoát ra
V lít khí ở đktc. Dung dịch thu được đem cô cạn thấy có 5,1 gam muối khan. Xác định giá trị của V.
1 mol muối cacbonat chuyển thành 1 mol muối clorua tạo ra 1 mol \(CO_2\) và khối lượng muối tăng : (M + 71) – ( M + 60) = 11g.
Theo đề bài, khối lượng muối tăng : 5,1 – 4 = 1,1 (g) sẽ có 0,1 mol \(CO_2\) thoát ra.
Vậy V = 2,24 lít

