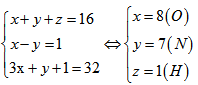Bài 3.17: Hãy viết cấu hình electron nguyên tử của agon (Ar) và cấu hình electron của các anion : \(S^{2-},Cl^-\).
Hãy so sánh cấu hình electron của các anion đó với cấu hình electron nguyên tử của Ar và cho nhận xét.
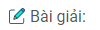
\(\begin{array}{l}
Ar:1{{\rm{s}}^2}2{{\rm{s}}^2}2{p^6}\underline {3{{\rm{s}}^2}3{p^6}} \\
{S^{2 – }}:1{{\rm{s}}^2}2{{\rm{s}}^2}2{p^6}\underline {3{{\rm{s}}^2}3{p^6}} \\
C{l^ – }:1{{\rm{s}}^2}2{{\rm{s}}^2}2{p^6}\underline {3{{\rm{s}}^2}3{p^6}}
\end{array}\)
Nhận xét : Các anion \(S^{2-},Cl^-\) có cấu hình electron giống cấu hình electron của nguyên tử khí hiếm Ar đứng sau.
Bài 3.18
a) Hãy cho biết có hiện tượng gì xảy ra khi cho clo (thường ở dạng \(Cl_2\)) tác dụng với natri và hãy giải thích sự hình thành liên kết ion trong phân tử NaCl
b) Hãy cho biết thế nào là liên kết ion và bản chất lực liên kết ion là gì ?
a) Ta đã biết natri là một kim loại có khuynh hướng nhường electron để trở thành một ion dương có cấu hình electron vững bền và clo là một phi kim có khuynh hướng nhận electron để trở thành một ion âm có cấu hình electron vững bền. Vì vậy khi cho clo tiếp xúc với natri thì trước hết có hiện tượng chuyển electron từ nguyên tử Na sang nguyên tử Cl. Từ đó xuất hiện các ion tích điện khác dấu (âm và dương) và sau đó do lực hút tĩnh điện giữa các ion nên liên kết ion được hình thành.
Phản ứng hoá học giữa natri và clo có thể được diễn tả bằng phương trình hoá học :
Advertisements (Quảng cáo)
b) Liên kết ion là liên kết giữa các ion, xuất hiện do sự chuyển electron từ nguyên tử kim loại sang nguyên tử phi kim.
Bản chất lực liên kết ion là lực hút tĩnh điện giữa các ion tích điện khác dấu.
Bài 3.19: a) Tại sao các hợp chất ion lại thường tồn tại ở trạng thái tinh thể ?
b)Hãy vẽ sơ đồ mạng tinh thể NaCl và hãy mô tả sự phân bố các ion trong mạng tinh thể đó.
Advertisements (Quảng cáo)
a) Lực hút tĩnh điện giữa các ion không định hướng : một ion dương có tác dụng hút đối với nhiều ion âm và ngược lại. Vì vậy, các hợp chất ion thường tồn tại ở dạng tinh thể. Các phân tử ion riêng rẽ chỉ tồn tại ở nhiệt độ cao (1440 °C đối với NaCl).
b) Hình bên là sơ đồ mạng tinh thể NaCl.
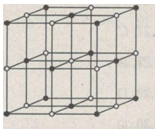
Trong tinh thể NaCl, các ion Na+; Cl– luân phiên phân bố trên các đỉnh của các hình lập phương nhỏ.
Mỗi ion được bao quanh bởi 6 ion khác dấu gần nhất.
Bài 3.20: Hãy cho biết tính chất chung của các hợp chất ion.
Vì lực hút tĩnh điện giữa các ion khác dấu lớn nên các tinh thể ion rất bền. Các hợp chất ion khó bay hơi, khó nóng chảy và khá rắn. Thí dụ, muối ăn (NaCl) có nhiệt độ nóng chảy là 800 °c.
Các hợp chất ion dễ tan trong nước. Ở trạng thái rắn, các hợp chất ion không dẫn điện nhưng dung dịch các hợp chất ion hoà tan trong nước và các hợp chất ion ở trạng thái nóng chảy đều là chất dẫn điện vì khi đó các ion tích điện có thể chuyển động tự do. Đó là đặc điểm của các hợp chất ion.
Bài 3.21: Dãy gồm các ion \(X^+\),\(Y^-\) và nguyên tử M đều có cấu hình electron \(1s^22s^22p^6\). Xác định X, Y và M.
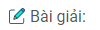 \(\begin{array}{l}
\(\begin{array}{l}
{X^ + }:1{s^2}2{{\rm{s}}^2}2{p^6} \to X:1{s^2}2{{\rm{s}}^2}2{p^6}3{s^1};Z = 11 \to X:Na\\
{Y^ – }:1{s^2}2{{\rm{s}}^2}2{p^6} \to Y:1{s^2}2{{\rm{s}}^2}2{p^5};{Z_Y} = 9\,\left( F \right)\\
M:1{s^2}2{{\rm{s}}^2}2{p^6} \to {Z_M} = 10\,\left( {Ne} \right)
\end{array}\)
Bài 3.22: Ba nguyên tử X, Y, Z có tổng điện tích hạt nhân bằng 16, nguyên tử X nhiều hơn nguyên tử Y một e. Tổng số e trong ion (\(YX_3)^-\) là 32. Xác định X, Y, Z.
Gọi số e trong mỗi nguyên tử X,Y,Z lần lượt là x,y,z. Theo đề bài ta có hệ phương trình đại số: