Bài 8.4: Viết phương trình hoá học thực hiện các biến hoá dưới đây, nêu rõ điều kiện của phản ứng và ghi tên các chất.
\(C{H_4}\)  ?
?  \({C_2}{H_4}\)
\({C_2}{H_4}\)  ?
? \(C{H_2} = CH – Cl\)
\(C{H_2} = CH – Cl\) 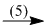 PVC
PVC
(1) 2\(C{H_4}\)  + 3\({H_2}\)
+ 3\({H_2}\)
metan axetilen
(2)  + \({H_2}\)
+ \({H_2}\) 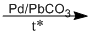 \(C{H_2} = C{H_2}\)
\(C{H_2} = C{H_2}\)
eten
(3) \(C{H_2} = C{H_2}\) + \(C{l_2}\) \( \to \) \(Cl – C{H_2} – C{H_2} – Cl\)
1,2-đicloetan
(4) \(Cl – C{H_2} – C{H_2} – Cl\) + KOH 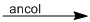 \(C{H_2} = C{H_2} – Cl + KCl + {H_2}O\)
\(C{H_2} = C{H_2} – Cl + KCl + {H_2}O\)
vinyl clorua
(5) \(C{H_2} = C{H_2} – Cl\) 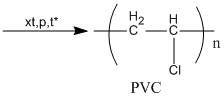
Bài 8.5: Viết phương trình hoá học của các phản ứng thực hiện các biến hoá dưới đây :
Advertisements (Quảng cáo)
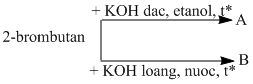
Ở đây A và B là các sản phẩm chính của phản ứng. Hãy viết các chất hữu cơ dưới dạng công thức cấu tạo
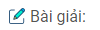
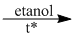 \(C{H_3} – CH = CH – C{H_3} + KBr + {H_2}O\)
\(C{H_3} – CH = CH – C{H_3} + KBr + {H_2}O\)
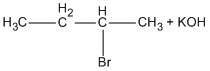
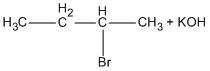
Bài 8.6: Đốt cháy hoàn toàn 3,96 g chất hữu cơ A, thu được 1,792 lít C02 (đktc) và 1,440 g H20. Nếu chuyển hết lượng clo có trong 2,475 g chất A thành AgCl thì thu được 7,175 g AgCl.
1. Xác định công thức đơn giản nhất của A.
2. Xác định công thức phân tử của A biết rằng tỉ khối hơi của A đối với etan là 3,3.
Advertisements (Quảng cáo)
3. Viết các công thức cấu tạo mà A có thể có và ghi tên từng chất theo hai cách đọc tên khác nhau.
1. Khi đốt cháy A ta thu được C02 và H20; vậy A phải chứa C và H.
Khối lượng C trong 1,792 lít C02 là : \(\frac{{12.1,792}}{{22,4}}\) = 0,96 (g).
Khối lượng H trong 1,44 g H20 : \(\frac{{2.1,44}}{{18}}\) = 0,16 (g).
Đó cũng là khối lượng C và H trong 3,96 g A.
Theo đầu bài A phải chứa Cl. Khối lượng Cl trong 7,175 g AgCl :
\(\frac{{35,5.7,175}}{{143,5}} = 1,775(g)\)
Đó cũng là khối lượng Cl trong 2,475 g A.
Vậy, khối lượng Cl trong 3,96 g A : \(\frac{{1,775.3,96}}{{2,475}}\) = 2,840 (g).
Khối lượng C, H và Cl đúng bằng khối lượng chất A (3,96 g).
Vậy, chất A có dạng CxHyClz.
x : y : z = \(\frac{{0,96}}{{12}}:\frac{{0,16}}{1}:\frac{{2,84}}{{35,5}}\) = 0,08 : 0,16 : 0,08 = 1 : 2 : 1
CTĐGN của A là CH2Cl.
2. MA = 3,3.30 = 99 (g/mol)
\( \Rightarrow {(C{H_2}Cl)_n}\) = 99 \( \Rightarrow \) 49,5n = 99 \( \Rightarrow \) n = 2
CTPT của A là C2H4Cl2.
3. Các CTCT
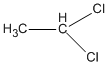 1,1-đicloetan
1,1-đicloetan
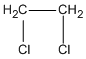 1,2-đicloetan (etylen clorua)
1,2-đicloetan (etylen clorua)

