Bài trắc nghiệm 2.46, 2.47
2.46. Khí nitơ có thể được tạo thành trong các phản ứng hoá học nào sau đây ?
A. Đốt cháy NH3 trong oxi có mặt chất xúc tác platin
B. Nhiệt phân NH4NO3
C. Nhiệt phân AgNO3
D. Nhiệt phân NH4NO2
2.47. Cặp chất nào sau đây có thể tồn tại trong cùng một dung dịch ?
A. Axit nitric và đồng(II) nitrat
B. Đồng(II) nitrat và amoniac
C. Bari hiđroxit và axit photphoric.
D. Amoni hiđrophotphat và kali hiđroxit
2.46. D
2.47. A
Bài tập trắc nghiệm 2.48: Hoà tan 12,8 g kim loại hoá trị II trong một lượng vừa đủ dung dịch \(HN{O_3}\) 60% (D = 1,365 g/ml), thu được 8,96 lít (đktc) một khí duy nhất màu nâu đỏ. Tên của kim loại và thể tích dung dịch \(HN{O_3}\) đã phản ứng là
A. đồng ; 61,5 ml.
B. chì ; 65,1 ml.
Advertisements (Quảng cáo)
C. thuỷ ngân ; 125,6 ml.
D. sắt; 82,3 ml.
2.48. A
\(M + 4HN{O_3} \to M{(N{O_3})_2} + 2N{O_2} \uparrow + 2{H_2}O\)
(màu nâu đỏ)
Số mol khí \(N{O_2}\) : \(\frac{{8,96}}{{22,4}}\) = 0,4 (mol).
Theo phương trình hoá học :
\({n_M}\) = 0,2 mol và \({n_{HN{O_3}}} = \frac{{0,4.4}}{2}\) = 0,8 (mol).
Khối lượng mol nguyên tử của kim loại M :
Advertisements (Quảng cáo)
M = \(\frac{{12,8}}{{0,2}} = 64(g/mol)\)
\( \Rightarrow \) kim loại là Cu (đồng).
Gọi V (ml) là thể tích của dung dịch HNO3 60%. Ta có phương trình liên hệ V với \({n_{HN{O_3}}}\) :
\(\frac{{V.1,365.60}}{{100.63}} = 0,8 \Rightarrow V = 61,5ml\)
Bài 2.49: Viết các phương trình hoá học thực hiện các dãy chuyển hoá sau :
1. \(N{H_4}Cl\)
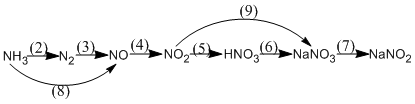
2. 
1. (1) \(N{H_4}Cl + NaOH \to N{H_3} + {H_2}O + NaCl\)
(2) \(4N{H_3} + 3{O_2}\) \(2{N_2} + 6{H_2}O\)
\(2{N_2} + 6{H_2}O\)
(3) \({N_2} + {O_2}\) 2NO
2NO
(4) \(2NO + {O_2} \to 2N{O_2}\)
(5) \(4N{O_2} + {O_2} + 2{H_2}O \to 4HN{O_3}\)
(6) \(HN{O_3} + NaOH \to NaN{O_3} + {H_2}O\)
(7) \(2NaN{O_3}\)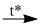 \(2NaN{O_2} + {O_2}\)
\(2NaN{O_2} + {O_2}\)
(8) \(4N{H_3} + 5{O_2}\)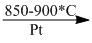 \(4NO + 6{H_2}O\)
\(4NO + 6{H_2}O\)
(9) \(2N{O_2} + 2NaOH \to NaN{O_3} + NaN{O_2} + {H_2}O\)
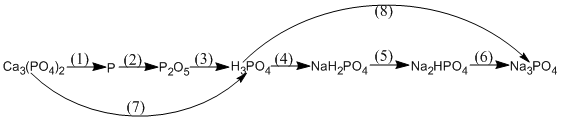
2. (1) \(C{a_3}{(P{O_4})_2} + 3Si{O_2} + 5C\)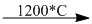 \(2P + 3CaSi{O_3} + 5CO\)
\(2P + 3CaSi{O_3} + 5CO\)
(2) \(4P + 5{O_2}\)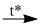 \(2{P_2}{O_5}\)
\(2{P_2}{O_5}\)
(3) \({P_2}{O_5} + 3{H_2}O \to 2{H_3}P{O_4}\)
(4) \({H_3}P{O_4} + NaOH \to Na{H_2}P{O_4} + {H_2}O\)
(5) \(Na{H_2}P{O_4} + NaOH \to N{a_2}HP{O_4} + {H_2}O\)
(6) \(N{a_2}HP{O_4} + NaOH \to N{a_3}P{O_4} + {H_2}O\)
(7) \(C{a_3}{(P{O_4})_2} + 3{H_2}S{O_4} \to 2{H_3}P{O_4} + 3CaS{O_4}\)
(8) \({H_3}P{O_4} + 3NaOH \to N{a_3}P{O_4} + 3{H_2}O\)

