7.64. Hiện tượng nào dưới đây đã miêu tả không đúng ?
A. Thổi khí NH3 qua CrO3 đốt nóng thấy chất rắn chuyển từ màu đỏ sang màu lục thẫm.
B. Nung Cr(OH)2 trong không khí thấy chất rắn chuyển từ màu lục xám sang màu lục thẫm.
C. Thêm lượng dư NaOH vào dung dịch K2Cr2O7 thì dung dịch chuyển từ màu da cam sang màu vàng.
D. Thêm lượng dư NaOH và Cl2 vào dung dịch CrCl2 thì dung dịch màu xanh chuyển sang màu vàng.
7.65. Có các phương trình hoá học sau :
1. CrO + 2HCl → CrCl2 + H2O
2. CrClO + 2NaOH → Cr(OH)2 + 2NaCl
3. 4Cr(OH)2 + O2 + 2H2O → 4Cr(OH)3
4. Cr(OH)2 + 2HCl → CrCl2 + 2H2O
5. 4CrCl2 + 4HCl + O2 → 4CrCl3 + 2H2O
Những phản ứng minh hoạ tính khử của hợp chất crom (II) là
A. 1,2. B. 3, 5. C.3,4. D. 2, 4.
7.66. Thể tích của dung dịch K2Cr2O7 0,05M vừa đủ phản ứng với dung dịch chứa 0,06 mol FeSO4 trong môi trường H2SO4 dư là
A. 100 ml. B. 150 ml. C. 200 ml. D. 250 ml.
|
7.64 |
7.65 |
7.66 |
|
B |
B |
C |
Bài 7.67: Cho sơ đồ các chuỗi phản ứng sau :
1) Cr2O3 → A1 → A2 → A3 → A4 → A5 → A6 → A7 → Cr2O3
Advertisements (Quảng cáo)
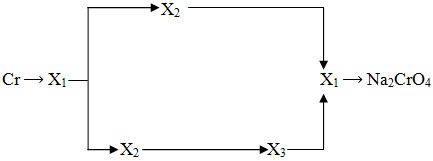
Biết rằng :
– A1 ….. A7 là các đơn chất hoặc hợp chất của crom.
– X1… X3 là các hợp chất của crom.
Hãy viết PTHH (có ghi điều kiện) theo các chuỗi phản ứng trên.
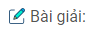
Dựa vào chất đã cho để suy luận theo sơ đồ các chuỗi phản ứng
Các chất A1…..A7 có thể là
A1: Cr A4: Cr(OH)3
A2 : CrCl2 A5: NaCrO2
Advertisements (Quảng cáo)
A3 : Cr(OH)2 A6: Na2CrO4 A7: Na2Cr2O7
Các chất X1. . . X3 có thể là :
X1: CrCl3 X2 : Cr(OH)3 X3 : NaCrO2
Bài 7.68: Muối kép KCr(SO4)2.12H2O tan trong nước. Hãy viết phương trình điện li của muối này và cho biết màu của dung dịch do ion nào gây ra.
KCr(SO4)2 → K+ + Cr3+ + 2SO4 2-
Ion Cr3+ trong dung dịch có màu xanh tím, còn ion K+, SO42- không màu. Vậy màu của dung dịch do ion Cr3+ gây ra.
Bài 7.69: Viết phương trình hoá học của các phản ứng trong quá trình chuyển hoá sau :
\(Cr\buildrel {(1)} \over
\longrightarrow CrC{l_3}\buildrel {(2)} \over
\longrightarrow Cr{(OH)_3}\buildrel {(3)} \over
\longrightarrow NaCr{O_2}\buildrel {(4)} \over
\longrightarrow N{a_2}Cr{O_4}\buildrel {(5)} \over
\longrightarrow N{a_2}C{r_2}{O_7}\)
(1) 2Cr + 3Cl2 → 2CrCl3
(2) CrCl3 + 3NaOH → Cr(OH)3 + 3NaCl
(3) Cr(OH)3 + NaOH → NaCrO2 + 2H2O
(4) 2NaCrO2 + 8NaOH + 3Br2 → 2Na2CrO4 + 6NaBr + 8H2O
(5) 2NaCrO4 + H2SO4 → Na2SO4 + Na2Cr2O7 + H2O.
Bài 7.70: Cho từ từ dung dịch NaOH vào dung dịch chứa 9,02 g hỗn hợp muối Al(NO3)3 và Cr(NO3)3 cho đến khi lượng kết tủa thu được là lớn nhất. Tách kết tủa ra khỏi dung dịch, rửa và nung đến khối lượng không đổi thu được 2,54 g chất rắn. Tính phần trăm khối lượng các muối trong hỗn hợp ban đầu.
Các phương trình hoá học :
Al(NO3)3 + 3NaOH → Al(OH)3↓+ 3NaNO3 ( 1 )
Cr(NO3)3 + 3NaOH → Cr(OH)3↓ + 3NaNO3 (2)
\(\eqalign{
& 2Al{\left( {OH} \right)_3}\buildrel {{t^0}} \over
\longrightarrow A{1_2}{O_3} + {\rm{ }}3{H_2}O(3) \cr
& 2Cr{\left( {OH} \right)_3}\buildrel {{t^0}} \over
\longrightarrow C{r_2}{O_3} + {\rm{ }}3{H_2}O(4) \cr} \)
Gọi x là số mol Al(NO3)3 và y là số mol Cr(NO3)3.
Ta có hệ pt: 213x + 238y = 9,02
\(102.{x \over 2} + 152.{y \over 2} = 2,54\)
→ x=y = 0,02
→ m Al(NO3)3 = 213.0,02= 4,26g→ %m Al(NO3)3 = 47,23%
%Cr(NO3)3 = 52,77%.

