7.48. Loại quặng sắt dùng để sản xuất gang thường chứa từ 30 – 95% oxit sắt và phải
A. chứa nhiều photpho.
B. chứa nhiều lưu huỳnh,
C. chứa nhiều SiO2.
D. chứa rất ít phot pho, lưu huỳnh
7.49. Trường hợp nào dưới đây không có sự phù hợp giữa nhiệt độ và phản ứng xảy ra trong lò cao ?
A. C + C02 → 2CO
B. CO + 3Fe2O3 → 2Fe3O4 + CO2
C. CO + Fe3O4 → 3FeO + CO2
D. CO + FeO → Fe+ CO2
7.50. Cho các nguyên liệu : (1) quặng sắt; (2) quặng boxit; (3) sắt thép phế liệu ; (4) gang trắng, gang xám , (5) than cốc ; (6) CaO ; (7) SiO2 ; (8) không khí giàu O2 ; (9) nhiên liệu (dầu, khí đốt). Các nguyên liệu dùng để sản xuất thép là
A. 1,5, 6, 7, 8. B. 3,4, 6, 8, 9.
Advertisements (Quảng cáo)
C. 2, 3, 4, 8,9. D. 3,4,6, 7, 8.
7.51. Để xác định hàm lượng cacbon trong thép (không chứa S) người ta cho O2 dư đi qua ống sứ đựng 15 gam thép, nung nóng và cho khí đi qua khỏi ống sứ hấp thụ hết vào bình đựng KOH rắn. Sau thí nghiệm khối lượng bình KOH tăng 0,44 gam. Phần trăm khối lượng cacbon trong thép đó là
A. 0,02%. B. 0,5%. C. 0,8%. D. 1,02%.
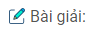
| 7.48 | 7.49 | 7.50 | 7.51 |
| D | D | B | C |
Bài 7.52: Từ 2,851 g gang sau khi chế hoá thích hợp, thu được 0,0825 g silic đioxit. Tính hàm lượng phần trăm của silic trong loại gang đó.
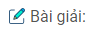
Khối lượng Si trong 0,0825 g SiO2là:
\(\eqalign{
& {{0.0825.28} \over {60}} = 0,0385g \cr
& \to \% {m_{Si}} = {{0,0385} \over {2,851}}.100 = 1,35\% \cr} \).
Advertisements (Quảng cáo)
Bài 7.53: Cần bao nhiêu tấn quặng manhetit có chứa 80% Fe3O4 để luyện được 100 tấn gang có 5% là các nguyên tố không phải sắt ? Biết trong quá trình luyện gang, lượng sắt bị hao hụt là 4%.
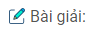
Khối lượng quặng : \(100.{{95} \over {100}}.{{100} \over {96}}.{{232} \over {168}}.{{100} \over {80}} = 170,82\) (tấn).
Bài 7.54: Khử a gam một oxit sắt bằng CO ở nhiệt độ cao, thu được 0,84 g Fe và 0,88 g CO2.
a) Viết phương trình hoá học của phản ứng ở dạng tổng quát.
b) Xác định công thức hoá học của oxit sắt đã dùng.
c) Tính thể tích dung dịch HCl 2M cần dùng để phản ứng hết a gam oxit sắt nói trên.
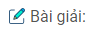
a) FexOy + yCO → xFe + yCO2 (1)
b) số mol các chất thu được sau phản ứng:
n Fe = 0,015 mol , n CO2 = 0,02 mol
Ta có: \({x \over y} = {{0,015} \over {0,02}} = {3 \over 4}\)
Công thức hóa học của oxit sắt là Fe3O4
c) Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O (2)
Theo đề bài trong a g oxit sắt có 0,84g sắt và 0,02 mol nguyên tử oxi
→ a = 0,84 + (16.0,02) = 1,16 → n Fe3O4 = 0,005 mol
Theo (2) n HCl = 8n Fe3O4 = 0,04 mol
\({V_{HCl}} = {{1000.0,04} \over 2} = 20ml\).

