Bài 28.9: Khí cacbon monooxit (CO) nguy hiểm là do có khả năng kết hợp với hemoglobin trong máu làm mất khả năng vận chuyển oxi của máu. Trong trường hợp nào sau đây, con người có thể bị tử vong do ngộ độc CO ?
A. Dùng bình gas để nấu nướng ở ngoài trời.
B. Đốt bếp lò trong nhà không được thông gió
C. Nổ (chạy) máy ôtô trong nhà xe đóng kín.
D. Cả trường hợp B và C.

Đáp án D.
Bài 28.10: Khí CO và CO2 bị coi là chất làm ô nhiễm môi trường vì
A. Nồng độ (%V) CO cho phép trong không khí là 10-20 phần triệu, nếu đến 50 phần triệu sẽ có hại cho não.
B. C02 tuy không độc nhưng gây hiệu ứng nhà kính làm Trái Đất nóng lên.
C. C02 cần cho cây xanh quang hợp nên không gây ô nhiễm.
D. Cả hai nguyên nhân A và B.

Advertisements (Quảng cáo)
Đáp án D.
Bài 28.11: Cacbon và oxi phản ứng theo phương trình hoá học sau : \(C + {O_2}\buildrel {{t^o}} \over\longrightarrow C{O_2}\)
. Nếu cho 1,20 gam cacbon phản ứng với 1,68 lít khí oxi (đktc) thì lượng tối đa cacbon đioxit sinh ra là :
A. 1,8 lít ; B. 1,68 lít ; C. 1,86 lít; D. 2,52 lít.

Đáp án B.
\({n_C} = {{1,2} \over {12}} = 0,1(mol);{n_{{O_2}}} = {{1,68} \over {22,4}} = 0,075(mol)\)
Phương trình hóa học :
Advertisements (Quảng cáo)
\(C\,\,\,\,\,\,\,\,\,\,\, + \,\,\,\,\,\,\,\,\,\,{O_2}\buildrel {{t^o}} \over\longrightarrow C{O_2}\)
0,075 mol 0,075 mol 0,075 mol
Số mol C dư nên tính số mol \(C{O_2}\) và \({O_2}\). Theo phương trình hóa học trên, số mol \(C{O_2}\) là 0,075 mol —> \({V_{C{O_2}}} = 1,68(l)\)
Bài 28.12: Khí CO sinh ra thường có lẫn một phần khí CO2. Hãy giới thiệu hai phương pháp hoá học có thể thu được khí CO trong phòng thí nghiệm và viết các phương trình hoá học.

– Dẫn hỗn hợp khí CO và CO2 đi qua dung dịch NaOH hoặc Ca(OH)2. Khí ra khỏi dung dịch kiềm là khí CO vì khí C02 đã tác dụng với dung dịch NaOH hoặc Ca(OH)2.
C02 + 2NaOH ——– > Na2CO3 +H2O
C02 + Ca(OH)2 ———> CaCO3 + H2O
– Hoặc dẫn hỗn hợp khí qua canxi oxit (CaO), khí đi ra là khí CO.
Bài 28.13: Qua thí nghiệm ở hình vẽ 3.4, em hãy viết phương trình hoá học của phản ứng xảy ra. Phản ứng hoá học này thuộc loại phản ứng nào ?
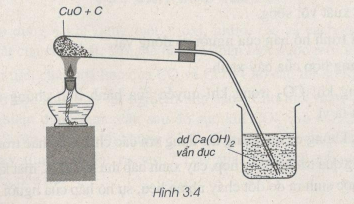

Phương trình hóa học: \(2CuO + C\buildrel {{t^o}} \over\longrightarrow C{O_2} + 2Cu\)
Phản ứng này là phản ứng oxi hóa -khử.
\(C{O_2} + Ca{(OH)_2} \to CaC{O_3} \downarrow + {H_2}O\)

