Bài 6.86: Một hỗn hợp rắn gồm Ca và CaC2 tác dụng với nước (dư) thu được hỗn hợp khí có tỉ khối đối với H2 là 5. Đế trung hoà dung dịch sau phản ứng, cần dùng 600 ml dung dịch HCl 0,5M. Tính :
a) Khối lượng của hỗn hợp rắn đã dùng ban đầu.
b) Thành phần phần trăm thể tích của hỗn hợp khí
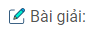
a) Ca + H2O → Ca(OH)2 + H2 (1)
CaC2 + 2H2O → Ca(OH)2 + C2H2 (2)
Ca(OH)2 + 2HCl→ CaCl2 + 2H2O (3)
\({n_{HCl}} = 0,3mol\)
Đặt x, y lần lượt là số mol Ca và CaC2 . Hỗn hợp khí thu được gồm H2 (x mol) và C2H2 (y mol)
Ta có hệ pt:
\(\eqalign{
& x + y = 0,15 \cr
& {{2x + 26y} \over {x + y}} = 10 \cr} \)
→ x= 0,1 mol ; y= 0,05 mol
Khối lượng hỗn hợp rắn ban đầu:
m Ca= 40.0,1=4 g mCaC2= 64.0,05= 3,2 g
→m hh= 7,2g
b) \(\eqalign{
& \% V{{\rm{ }}_{{H_2}}} = {{0.1} \over {0.15}}.100 = 66,67\% \cr
& \% {V_{{C_2}{H_2}}} = 33,33\% \cr} \)
Bài 6.87: Một bình kín có dung tích 5 lít chứa khí ở áp suất 1,4 atm và 27°c. Đốt cháy 12 g kim loại kiềm thổ trong bình kín trên. Sau phản ứng, nhiệt độ và áp suất trong bình là 136,5°C và 0,903 atm. Biết thể tích bình không đổi, thể tích chất rắn không đáng kể. Xác định kim loại kiềm thổ đem đốt.
2M + O2 → 2MO
Advertisements (Quảng cáo)
Thể tích O2 (đktc) có trong bình trước phản ứng:
\(V = {{273.1,4.5} \over {1.(273 + 27)}} = 6,37l\)
Thể tích khí O2 còn lại trong bình sau phản ứng: \({V’} = {{273.0,903.5} \over {1.(273 + 136,5)}} = 3,01l\)
Thể tích khí O2 tham gia phản ứng: 6,37- 3,01= 3,36 l hay 0,15 mol O2.
→ số mol kim loại tham gia phản ứng là 0,3 mol
Khối lượng mol của M là \({{12} \over {0,3}} = 40(g/mol) \to \) M là canxi.
Bài 6.88: Hoà tan 1,04 g muối clorua của kim loại kiềm thổ trong nước thu được dung dịch A. Thêm Na2CO3 dư vào dung dịch A được một kết tủa. Hoà tan kết tủa này trong dung dịch HNO3 được dung dịch B. Thêm H2SO4 dư vào dung dịch B được kết tủa mới có khối lượng 1,165 g. Xác định công thức hoá học của muối clorua kim loại kiềm .
\(MC{l_2}\buildrel { + N{a_2}C{O_3}} \over
\longrightarrow MC{O_3}\buildrel { + HN{O_3}} \over
\longrightarrow M{(N{O_3})_2}\buildrel { + {H_2}S{O_4}} \over
\longrightarrow MS{O_4}\)
Đặt X là khối lượng mol của kim loại kiểm thổ.
Theo sơ đồ phản ứng : 1 mol MCl2 →1 mol MSO4
(X + 71) g MC12 → (X + 96) g MSO4
Advertisements (Quảng cáo)
1,04 g MC12 → 1,165 g MSO4
⟹ 1,165.(X + 71) = 1,04.(X + 96)
Giải ra được X = 137. Vậy M là Ba, muối là BaCl2.
Bài 6.89: Cho 10,6 g hỗn hợp A gồm một kim loại kiềm X và một kim loại kiềm thổ Y tác dụng hết với 300 ml dung dịch HCl 1M (loãng), thu được dung dịch B và 5,6 lít khí (đktc).Dẫn từ từ khí CO2 vào dung dịch B. Số gam kết tủa cực đại thu được là bao nhiêu.
Đặt hai kim loại là \(\overline R \), có hoá trị n (1 < n< 2), ta có phương trình cho nhận e :
\(\overline R \to \overline {{R^{n + }}} + ne\) \(2{H^ + } + 2{\rm{e}} \to {H_2}\)
Với số mol H2là 0,25 (mol) ⟹ số mol R là \({{0,5} \over n}\) (mol)
\( \Rightarrow {M_{\overline R }} = 21,2n\)
Với \(1 \le n \le 2 \to 21,2 \le {M_R} \le 42,2\)
Vậy 2 kim loại cần tìm có thể là 2 trong 4 kim loại sau : Na, K, Mg, Ca.
Mặt khác ta có : nHCl = 0,3 mol ⟹ nH2 = 0,15mol, vậy 0,1 mol H2 còn lại do H2O phản ứng tạo ra ⟹ loại Mg vì Mg không phản ứng với nước
⟹ hai kim loại là Na và Ca với số mol tương ứng là x và y
Ta có hệ:
23x + 40y = 10,6 (1)
x + 2y = 0,25.2 = 0,5 (2)
từ (1) và (2) ⟶ x = 0,2 ; y = 0,15
Ta lại có số mol Họ do nước tạo ra là 0,1 mol ⟹ số mol OH– là 0,2 mol
Để tạo kết tủa cực đại tức là toàn bộ CO2 tạo muối CO3 2-
\({{{n_{O{H^ – }}}} \over {{n_{C{O_2}}}}} = 2 \Rightarrow {n_{CO_3^{2 – }}} = {n_{C{O_2}}} = {{0,2} \over 2} = 0,1mol\)
Vậy kết tủa là CaCO3 : 0,1 mol ⟹ m = 0,1.100 = 10 (gam).
Bài 6.90: Hoà tan 0,1 mol phèn nhôm – amoni (NH4)2SO4.Al2(SO4)3.24H2O vào nước được dung dịch X. Cho đến dư dung dịch Ba(OH)2 vào dung dịch X (đun nóng) thì thu được kết tủa Y và khí Z. Xác định khối lượng kết tủa Y và thể tích (đktc) khí Z.
– Dung dịch Ba(OH)2 dư nên Al(OH)3 sinh ra rồi tan hết.
– Phèn amoni (NH4)2SO4.Al2(SO4)3.24H2O: 0,1 mol
⟹ nSO42- = 0,4 mol và nNH4+ = 0,2 mol
Kết tủa Y : Ba2+ + SO42-→ BaS04 ↓
→m↓ = mBaSO4= 0,4.233 = 93,2 (g)
Khí Z : NH4 + + OH– → NH3↑+H2O
⟹ VNH3 = 0,2.22,4 = 4,48 (lít).

