Bài 6.36: So sánh kim loại Mg và Ca về các mặt:
a) Cấu hình electron của nguyên tử.
b) Tác dụng với nước.
c) Phương pháp điều chế các đơn chất.
a) Cấu hình electron : Mg : [Ne]3s2; Ca : [Ar]4s2
b) Tác dụng với nước : Ca tác dụng với nước ở điều kiện thường còn Mg không tác dụng.
c) Phương pháp điều chế : Cả Ca và Mg đều được điều chế bằng phương pháp điện phân nóng chảy hai muối MgCl2 và CaCl2.
Bài 6.37: Hãy dẫn ra những phản ứng để chứng tỏ rằng từ Be đến Ca, tính kim loại của các nguyên tố tăng dần.
Phản ứng vớỉ nước :
– Be không tác dụng với nước ở nhiệt độ thường.
– Mg tác dụng chậm với nước nóng.
– Ca tác dụng với nước ở nhiệt độ thường
Tính chất của hiđroxit :
Be(OH)2 có tính lưỡng tính.
Mg(OH)2 là bazơ yếu.
Ca(OH)2 là bazơ mạnh.
Advertisements (Quảng cáo)
Bài 6.38: Sục hỗn hợp khí CO2 và CO vào dung dịch Ca(OH)2 thấy có kết tủa. Lọc bỏ kết tủa, thu được dung dịch nước lọc. Đổ dung dịch NaOH vào nước lọc thấy xuất hiện kết tủa. Viết phương trình hoá học của các phản ứng xảy ra trong thí nghiệm trên.
CO2 + Ca(OH)2 → CaCO3↓+ H2O (1)
CaCO3 + CO2 + H2O → Ca(HCO3)2 (2)
Ca(HCO3)2 + 2NaOH → CaCO3+ Na2CO3 + 2H2O (3).
Bài 6.39: Nước trong vùng có núi đá vôi thuộc loại nước cứng. Viết phương trình hoá học của các phản ứng mô tả sự tạo thành nước cứng.
Trong thành phần của đá vôi có các hợp chất CaCO3, MgCO3. Nước mưa hoà tan khí CO2 trong không khí đã hoà tan dần các hợp chất CaCO3,MgCO3
\(\matrix{
{CaC{O_3} + {\rm{ }}C{O_2} + {\rm{ }}{H_2}O \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over
{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{ }}Ca{{\left( {HC{O_3}} \right)}_2}} \hfill \cr
{MgC{O_3} + {\rm{ }}C{O_2} + {\rm{ }}{H_2}O{\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over
{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} Mg{{\left( {HC{O_3}} \right)}_2}} \hfill \cr}\)
Bài 6.40: Về mặt hoá học thì nước có tính cứng tạm thời và nước có tính cứng vĩnh cửu khác nhau ở điểm nào ?
Khác nhau về thành phần anion của muối.
Advertisements (Quảng cáo)
– Nước có tính cứng tạm thời chứa anion HCO3– khi đun nóng bị phân huỷ thành ion cacbonat làm kết tủa Ca2+ và Mg2+ .
– Nước có tính cứng vĩnh cửu chứa các anion SO42- và Cl–, khi đun nóng không làm kết tủa Ca2+ và Mg2+
Bài 6.41: Có 4 cốc đựng riêng biệt các loại nước : nước cất, nước có tính cứng tạm thời, nước có tính cứng vĩnh cửu và nước có tính cứng toàn phần. Hãy xác định loại nước đựng trong 4 cốc trên bằng phương pháp hoá học. Viết phương trình hoá học của các phản ứng đã dùng.
Đun sôi nước trong các cốc ta sẽ chia ra thành 2 nhóm :
(1) Không thấy vẩn đục là nước cất và nước có tính cứng vĩnh cửu.
(2) Thấy vẩn đục là nước có tính cứng tạm thời và nước có tính cứng toàn phần.
+ Thêm vài giọt dung dịch Na2CO3 vào mỗi cốc của nhóm (1). Nếu có kết tủa là nước có tính cứng vĩnh cửu, không có kết tủa là nước cất.
+ Lấy nước lọc của mỗi cốc ở nhóm (2) (sau khi đun sôi để nguội) cho thêm vài giọt dung dịch Na2CO3. Nếu có kết tủa là nước có tính cứng toàn phần, không có kết tủa là nước có tính cứng tạm thời.
Bài 6.42: Viết PTHH của các phản ứng trong sơ đồ biến hoá sau :
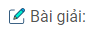
\((1)\,Ca + 2C\buildrel {{t^0}} \over
\longrightarrow Ca{C_2}\)
(2) CaC2 + 2HCl→ CaCl2 + C2H2
\(\eqalign{
& (3)\,CaC{l_2} + 2{H_2}O\mathrel{\mathop{\kern0pt\longrightarrow}
\limits_{mangngan}^{dp{\rm{dd}}}} Ca{(OH)_2} + C{l_2} + {H_2} \cr
& (4)\,Ca{(OH)_2}\buildrel {{t^0}} \over
\longrightarrow CaO + {H_2}O \cr} \)
(5) CaO + CO2 → CaCO3
(6) CaCO3 + CO2 + H2O → Ca(HCO3)2
\((7)\,Ca{(HC{O_3})_2}\buildrel {{t^0}} \over
\longrightarrow CaC{O_3} + C{O_2} + {H_2}O\)
(8) Ca(NO3)2 → Ca(NO2)2 + O2
(9) CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
(10) CaCl2 + 2AgNO3 → Ca(NO3)2 + AgCl
(11) CaCO3 + 2HCl → CaCl2 + H2O + CO2
(12) Ca + CO2 + H2O → CaCO3 + H2
(13) Ca + 2H2O → Ca(OH)2 + H2
(14) Ca(OH)2 dư + CO2 → CaCO3 + H2O
(15) Ca(OH)2 + Cl2 → CaOCl2 + H2O
(16) CaOCl2 + 2HCl → CaCl2 + H2O + CO2
Hoặc \(2CaOC{l_2}\buildrel {CO} \over
\longrightarrow 2CaC{l_2} + {O_2}\)

