Bài 1: Hợp chất nào của nhôm tác dụng với dung dịch \(NaOH\) (theo tỉ lệ mol 1:1) cho sản phẩm \(Na\left[ {Al{{(OH)}_4}} \right]\)
\(\eqalign{
& A.A{l_2}{(S{O_4})_3} \cr
& B.AlC{l_3} \cr
& C.Al{(N{O_3})_3} \cr
& D.Al{(OH)_3} \cr} \)
Chọn D.
\(NaOH + Al{(OH)_3} \to Na\left[ {Al{{(OH)}_4}} \right].\)
Bài 2: Dãy nào dưới đây gồm các chất vừa tác dụng được với dung dịch axit vừa tác dụng được với dung dịch kiềm?
A. \(AlC{l_3}\) và \(A{l_2}{\left( {S{O_4}} \right)_3}\)
B. \(Al{(N{O_3})_3}\) và \(Al{\left( {OH} \right)_3}\)
C. \(A{l_3}{(S{O_4})_3}\) và \(A{l_2}{O_3}\)
D. \(Al{\left( {OH} \right)_3}\) và \(A{l_2}{O_3}\).
Chọn D.
\(Al{\left( {OH} \right)_3}\) và \(A{l_2}{O_3}\) có tính lưỡng tính. Do đó vừa tác dụng với dung dịch axit vừa tác dụng được với dung dịch kiềm.
\(\eqalign{
& Al{(OH)_3} + 3HCl \to AlC{l_3} + 3{H_2}O. \cr
& Al{(OH)_3} + NaOH \to Na\left[ {Al{{(OH)}_4}} \right]. \cr
& A{l_2}{O_3} + 6HCl \to 2AlC{l_3} + 3{H_2}O. \cr
& A{l_2}{O_3} + 2NaOH + 3{H_2}O \to 2Na\left[ {Al{{(OH)}_4}} \right]. \cr} \)
Bài 3: Có 3 chất rắn là: \(Mg,{\rm{ }}A{l_2}{O_3},{\rm{ }}Al\). Hãy nhận biết mỗi chất đã cho bằng phương pháp hóa học. Viết phương trình hóa học.
Cho 3 mẫu thử vào 3 ống nghiệm đựng dung dịch \(NaOH\).
+ Mẫu không tan là \(Mg\).
+ Mẫu tan và không sủi bọt khí là \(A{l_2}{O_3}\).
Advertisements (Quảng cáo)
\(A{l_2}{O_3} + 2NaOH + 3{H_2}O \to 2Na\left[ {Al{{(OH)}_4}} \right].\)
+ Mẫu tan và sủi bọt khí là \(Al\).
\(2Al + 2NaOH + 6{H_2}O \to 2Na\left[ {Al{{(OH)}_4}} \right] + 3{H_2} \uparrow .\)
Bài 4: Viết phương trình hóa học biểu diễn những chuyển đổi hóa học sau, ghi rõ điều kiện của phản ứng và cho biết phản ứng nào thuộc loại phản ứng oxi hóa – khử:
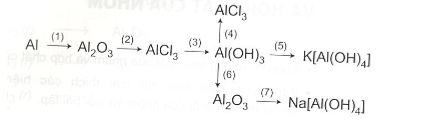
\(\eqalign{
& (1)\;4Al + 3{O_2}\buildrel {{t^0}} \over
\longrightarrow 2A{l_2}{O_3}. \cr
& (2)\;A{l_2}{O_3} + 6HCl \to 2AlC{l_3} + 3{H_2}O. \cr
& (3)\;AlC{l_3} + 3NaO{H}_{đủ} \to Al{(OH)_3} \downarrow + 3NaCl. \cr
& (4)\;Al{(OH)_3} + 3HCl \to AlC{l_3} + 3{H_2}O. \cr
& (5)\;Al{(OH)_3} + KOH \to K\left[ {Al{{(OH)}_4}} \right]. \cr} \)
\(\eqalign{
& (6)\;2Al{(OH)_3}\buildrel {{t^0}} \over
\longrightarrow A{l_2}{O_3} + 3{H_2}O. \cr
& (7)\;A{l_2}{O_3} + 2NaOH + 3{H_2}O \to 2Na\left[ {Al{{(OH)}_4}} \right]. \cr} \)
Bài 5: Có các dung dịch \(AlC{l_3},{\rm{ }}HCl,{\rm{ }}NaOH,{\rm{ }}{H_2}O\) và các dụng cụ cần thiết. Hãy điều chế và chứng minh tính lưỡng tính của \(A{l_2}{O_3}\) và \(Al{\left( {OH} \right)_3}\). Viết phương trình hóa học.
– Điều chế \(A{l_2}{O_3};{\rm{ }}Al{\left( {OH} \right)_3}\):
\(\eqalign{
& AlC{l_3} + 3NaOH_{đủ}\to Al{(OH)_3} \downarrow + 3NaCl. \cr
&2Al{(OH)_3}\buildrel {{t^0}} \over
\longrightarrow A{l_2}{O_3} + 3{H_2}O. \cr} \)
Advertisements (Quảng cáo)
– Chứng minh tính lưỡng tính của \(A{l_2}{O_3}\) và \(Al{\left( {OH} \right)_3}.\)
\(A{l_2}{O_3}\) và \(Al{\left( {OH} \right)_3}\) vừa cho proton \({H^ + }\) vừa nhận proton \({H^ + }\)
\(\eqalign{
& Al{(OH)_3} + 3HCl \to AlC{l_3} + 3{H_2}O. \cr
& Al{(OH)_3} + NaOH \to Na\left[ {Al{{(OH)}_4}} \right]. \cr
& A{l_2}{O_3} + 6HCl \to 2AlC{l_3} + 3{H_2}O. \cr
& A{l_2}{O_3} + 2NaOH + 3{H_2}O \to 2Na\left[ {Al{{(OH)}_4}} \right]. \cr} \)
Bài 6: Cho \(31,2\) gam hỗn hợp bột \(Al\) và \(A{l_2}{O_3}\) tác dụng với dung dịch \(NaOH\) dư. Phản ứng xảy ra hoàn toàn, thu được \(13,44\) lít \({H_2}\) (đktc). Hãy cho biết:
a) Các phương trình hóa học của các phản ứng đã xảy ra.
b) Khối lượng mỗi chất có trong hỗn hợp ban đầu.
c) Thể tích dung dịch \(NaOH\; 4M\) đã dùng (biết rằng trong thí nghiệm này người ta đã dùng dư \(10{\rm{ }}\;c{m^3}\) so với thể tích cần dùng).
Ta có:
\(\eqalign{
& {n_{{H_2}}} = {{13,44} \over {22,4}} = 0,6(mol). \cr
& 2Al + 2NaOH + 6{H_2}O \to 2Na\left[ {Al{{(OH)}_4}} \right] + 3{H_2} \uparrow (1) \cr} \)
\(0,4\; \leftarrow \;\;0,4 \) \(\leftarrow\) \( 0,6\)
\(A{l_2}{O_3} + 2NaOH + 3{H_2}O \to 2Na\left[ {Al{{(OH)}_4}} \right](2)\)
\(\eqalign{
& b) \Rightarrow {m_{Al}} = 0,4.27 = 10,8(g); \cr
& {m_{A{l_2}{O_3}}} = 31,2 – 10,8 = 20,4(g). \cr
& \Rightarrow {n_{A{l_2}{O_3}}} = {{20,4} \over {102}} = 0,2(mol). \cr
& \cr} \)
c) \(A{l_2}{O_3} + 2NaOH + 3{H_2}O \to 2Na\left[ {Al{{(OH)}_4}} \right](2)\)
\(0,2\) \(\rightarrow\) \(0,4\)
\({n_{NaOH}} = 0,4\;mol.\)
Số mol \(NaOH\) đã dùng là: \(0,4 + 0,4 = 0,8\).
Thể tích dung dịch \(NaOH\; 4M\) đã dùng là:
\({V_{NaOH}} = {{0,8} \over 4} = 0,2(l) = 200(ml).\)
Thể tích dung dịch \(NaOH\) thực dùng là: \({V_{NaOH}} = 200 + 10 = 210{\rm{ }}(c{m^3})\).
Bài 7: Cho \(150{\rm{ }}c{m^3}\) dung dịch \(NaOH\,\,7M\) tác dụng với \(100{\rm{ }}c{m^3}\) dung dịch \(A{l_2}{(S{O_4})_3}\; 1M\). Hãy xác định nồng độ mol của các chất có trong dung dịch sau phản ứng.
Ta có:
\(\eqalign{
& {n_{NaOH}} = 0,15.7 = 1,05(mol); \cr
& {n_{A{l_2}{O_3}}} = 0,1.1 = 0,1(mol) \cr
& A{l_2}{(S{O_4})_3} + 6NaOH \to 3N{a_2}S{O_4} + 2Al{(OH)_3}. \cr} \)
\(0,1\) \( \to\) \( 0,6\) \( \to\) \( 0,3\) \( \to \) \(0,2\)
\(Al{(OH)_3} + NaOH \to Na\left[ {Al{{(OH)}_4}} \right]\)
\(0,2\) \( \to \) \(0,2\) \( \to \) \(0,2\)
Dung dịch sau phản ứng gồm:
\(\eqalign{
& \left\{ \matrix{
N{a_2}S{O_4}:0,3(mol) \hfill \cr
Na\left[ {Al{{(OH)}_4}} \right]:0,2(mol) \hfill \cr
NaO{H_{dư}}:1,05 – (0,2 + 0,6) = 0,25(mol). \hfill \cr} \right. \cr
& \Rightarrow {CM_{{{N{a_2}S{O_4}}}}} = {{0,3} \over {0,25}} = 1,2M;{CM_{{{Na\left[ {Al{{(OH)}_4}} \right]}}}} = {{0,2} \over {0,25}} = 0,8M;{CM_{{{NaOH}}}} = {{0,25} \over {0,25}} = 1M. \cr} \)

