Bài 1: Chất nào sau đây không bị phân hủy khi nung nóng?
\(\eqalign{
& A.Mg{\left( {N{O_3}} \right)_2} \cr
& B.CaC{O_3} \cr
& C.CaS{O_4} \cr
& D.Mg{\left( {OH} \right)_2} \cr} \)
Chọn C
Bài 2: Theo thuyết Bron-stet, ion nào sau đây (trong dung dịch) có tính lưỡng tính?
\(\eqalign{
& A.CO_3^{ – 2} \cr
& B.O{H^ – } \cr
& C.C{a^{2 + }} \cr
& D.HCO_3^ – \cr} \)
Chọn D
Bài 3: Nước tự nhiên có chứa những ion nào dưới đây thì được gọi là nước có tính cứng tạm thời?
\(\eqalign{
& A.C{a^{2 + }},M{g^{2 + }},Cl^- \cr
& B.C{a^{2 + }},M{g^{2 + }},SO_4^{ 2-} \cr
& C.C{l^ – },SO_4^{2\_},HCO_3^ – ,C{a^{2 + }} \cr
& D.HCO_3^ – ,C{a^{2 + }},M{g^{2 + }}. \cr} \)
Chọn D.
Bài 4: Một loại nước cứng khi được đun sôi thì mất tính cứng. Trong loại nước cứng này có hòa tan những hợp chất nào sau đây?
\(\eqalign{
& A.Ca{\left( {HC{O_3}} \right)_2},MgC{l_2} \cr
& B.Ca{\left( {HC{O_3}} \right)_2},Mg{\left( {HC{O_3}} \right)_2} \cr
& C.Mg{\left( {HC{O_3}} \right)_2},CaC{l_2} \cr
& D.MgC{l_2},CaS{O_4}. \cr} \)
Nước cứng khi đun sôi mất tính cứng là nước cứng tạm thời.
\(\eqalign{
& Ca{\left( {HC{O_3}} \right)_2}\buildrel {{t^0}} \over
\longrightarrow CaC{O_3} \downarrow + C{O_2} \uparrow + {H_2}O. \cr
& Mg{\left( {HC{O_3}} \right)_2}\buildrel {{t^0}} \over
\longrightarrow MgC{O_3} \downarrow + C{O_2} \uparrow + {H_2}O. \cr} \)
Chọn B.
Bài 5: Cho các chất:
\(\eqalign{
& A.NaCl \cr
& B.Ca{\left( {OH} \right)_2} \cr
& C.N{a_2}C{O_3} \cr
& D.HCl \cr
& E.BaC{l_2} \cr
& F.Na_2S{O_4} \cr} \)
Những chất nào có thể:
a) Làm mềm nước có tính cứng tạm thời?
b) Làm mềm nước có tính cứng vĩnh cửu?
Viết phương trình hóa học.
a) Chọn B và C. Chất có thể làm mềm nước cứng tạm thời là \(Ca{\left( {OH} \right)_2}\) (lượng dùng vừa đủ); \(N{a_2}C{O_3}\)
\(\eqalign{
& Ca{\left( {HC{O_3}} \right)_2} + Ca{\left( {OH} \right)_2} \to 2CaC{O_3} \downarrow + 2{H_2}O. \cr
& Mg{\left( {HC{O_3}} \right)_2} + 2Ca{\left( {OH} \right)_2} \to Mg{\left( {OH} \right)_2} \downarrow + 2CaC{O_3} \downarrow + 2{H_2}O. \cr
& Ca{\left( {HC{O_3}} \right)_2} + N{a_2}C{O_3} \to CaC{O_3} \downarrow + 2NaHC{O_3}. \cr
& Mg{\left( {HC{O_3}} \right)_2} + N{a_2}C{O_3} \to MgC{O_3} \downarrow + 2NaHC{O_3}. \cr} \)
b) Chất có thể làm mềm nước cứng vĩnh cửu: \(N{a_2}C{O_3}\)
\(\eqalign{
& CaC{l_2} + N{a_2}C{O_3} \to CaC{O_3} \downarrow + 2NaCl. \cr
& MgC{l_2} + N{a_2}C{O_3} \to MgC{O_3} \downarrow + 2NaCl. \cr} \)
Bài 6: a) Có 4 chất rắn đựng trong 4 lọ riêng biệt: \(N{a_2}C{O_3},{\rm{ }}CaC{O_3},{\rm{ }}N{a_2}S{O_4},{\rm{ }}CaS{O_4}.2{H_2}O\).
Bằng cách nào để phân biệt được các chất, nếu ta chỉ dùng nước và dung dịch axit clohiđric ?
b) Có 3 chất rắn đựng trong 3 lọ riêng biệt là \(NaCl,CaC{l_2}\) và \(MgC{l_2}\). Hãy trình bày phương pháp hóa học để phân biệt các chất (có đủ dụng cụ và những hóa chất cần thiết).
Advertisements (Quảng cáo)
a) Nhận biết 4 chất rắn riêng biệt: \(N{a_2}C{O_3},{\rm{ }}CaC{O_3},{\rm{ }}N{a_2}S{O_4},{\rm{ }}CaS{O_4}.2{H_2}O\) bằng \({H_2}O\) và dung dịch \(HCl\):
– Dùng nước thu được 2 nhóm sau:
+ Nhóm tan trong nước: \(N{a_2}C{O_3};{\rm{ }}N{a_2}S{O_4}\).
+ Nhóm không tan trong nước: \(CaC{O_3};{\rm{ }}CaS{O_4}.2{H_2}O\).
Cho dung dịch \(HCl\) vào hai mẫu của nhóm không tan.
Mẫu sủi bọt khí là \(N{a_2}C{O_3}\). Mẫu còn lại là \(N{a_2}S{O_4}\).
\(N{a_2}C{O_3} + 2HCl \to 2NaCl + C{O_2} \uparrow + {H_2}O.\)
Cho dung dịch \(HCl\) vào hai mẫu của nhóm không tan.
Mẫu sủi bọt khí là \(CaC{O_3}\). Mẫu còn lại là \(CaS{O_4}.2{H_2}O\)
\(\eqalign{
& CaC{O_3} + 2HCl \to CaC{l_2} + C{O_2} \uparrow + {H_2}O. \cr
& \cr} \)
b) Nhận biết 3 chất rắn riêng biệt: \(NaCl, CaCl_2\) và \(MgCl_2\).
Hòa tan các chất rắn vào nước cất thu được các dung dịch loãng riêng biệt. Dùng dung dịch \(NaOH\) nhận biết được dung dịch \(MgCl_2\) vì tạo ta kết tủa trắng đục. Hai mẫu còn lại là \(NaCl\) và \(CaCl_2\).
\(MgC{l_2} + 2NaOH \to Mg{\left( {OH} \right)_2} \downarrow + 2NaCl.\)
Dùng dung dịch \(N{a_2}C{O_3}\) nhận biết được \(CaC{l_2}\) vì tạo ra kết tủa trắng.
\(CaC{l_2} + N{a_2}C{O_3} \to CaC{O_3} \downarrow + 2NaCl.\)
Mẫu còn lại là \(NaCl\).
Bài 7: Trong tự nhiên,các nguyên tố canxi và magie có trong quặng đôlômit: \(CaC{O_3}.MgC{O_3}\).Từ quặng này, hãy trình bày phương pháp hóa học điều chế:
a) Hai chất riêng biệt là \(CaC{O_3}\) và \(MgC{O_3}\);
b) Hai kim loại riêng biệt là \(Ca\) và \(Mg\).
Viết các phương trình hóa học.
a) Hai chất \(CaC{O_3}\) và \(MgC{O_3}\) riêng biệt
Advertisements (Quảng cáo)
– Nhiệt phân quặng đolomit thu hỗn hợp \(CaO\) và \(MgO\).
\(CaC{O_3}.MgC{O_3}\buildrel {{t^0}} \over
\longrightarrow CaO.MgO + 2C{O_2} \uparrow \)
– Hòa tan hỗn hợp \(CaO\) và \(MgO\) vào nước, \(CaO\) tan tạo huyền phù và \(MgO\) không tan.
\(CaO + {H_2}O \to Ca{\left( {OH} \right)_2}\)
– Thổi \(CO_2\) dư vào, lọc thu dung dịch \(Ca{(HC{O_3})_2}\) và phần không tan \(MgO\).
\(\eqalign{
& C{O_2} + Ca{(OH)_2} \to CaC{O_3} \downarrow + {H_2}O. \cr
& CaC{O_3} + C{O_2}d{\rm{ư + }}{{\rm{H}}_2}O \to Ca{\left( {HC{O_3}} \right)_2}. \cr} \)
– Cô cạn dung dịch và nung thu được \(CaC{O_3}\).
\(\eqalign{
& Ca{\left( {HC{O_3}} \right)_2}\buildrel {{t^0}} \over
\longrightarrow CaC{O_3} \downarrow + C{O_2} \uparrow + {H_2}O. \cr
& \cr} \)
– Hòa tan \(MgO\) vào dung dịch \(HCl\) rồi cho dung dịch tạo thành tác dụng với dung dịch \(N{a_2}C{O_3}\), lọc thu được \(MgC{O_3}\).
\(\eqalign{
& MgO + 2HCl \to MgC{l_2} + {H_2}O. \cr
& MgC{l_2} + N{a_2}C{O_3} \to MgC{O_3} \downarrow + 2NaCl. \cr} \)
b) Hai kim loại \(Ca\) và \(Mg\) riêng biệt
Từ hai muối \(CaC{O_3}\) và \(MgC{O_3}\) đã tách được ở câu a. Hòa tan riêng từng muối vào dung dịch \(HCl\), cô cạn dung dịch rồi tiến hành điện phân nóng chảy các muối clorua thu được \(Ca\) và \(Mg\).
\(\eqalign{
& CaC{O_3} + 2HCl \to CaC{l_2} + C{O_2} \uparrow + {H_2}O. \cr
& MgC{O_3} + 2HCl \to MgC{l_2} + C{O_2} \uparrow + {H_2}O. \cr
& CaC{l_2}\buildrel {dpnc} \over
\longrightarrow Ca + C{l_2} \uparrow \cr
& MgC{l_2}\buildrel {dpnc} \over
\longrightarrow Mg + C{l_2} \uparrow \cr} \)
Bài 8: Dựa vào bảng tính tan của một số hợp chất kim loại kiềm thổ (xem phần tư liệu). Hãy xét xem phản ứng nào sau đây xảy ra:
\(\eqalign{
& Mg{\left( {OH} \right)_2} + C{a^{2 + }} \to Ca{\left( {OH} \right)_2} + M{g^{2 + }} \cr
& Ca{\left( {OH} \right)_2} + M{g^{2 + }} \to Mg{\left( {OH} \right)_2} + C{a^{2 + }} \cr} \)
\( \bullet Mg{\left( {OH} \right)_2} + C{a^{2 + }} \to Ca{\left( {OH} \right)_2} + M{g^{2 + }}\)
Phản ứng này không xảy ra vì không thỏa mãn điều kiện trao đổi ion \(Mg{\left( {OH} \right)_2}\) là chất kết tủa độ tan \(0,{2.10^{ – 4}}\) mol /100g \({H_2}O\).
\( \bullet Ca{\left( {OH} \right)_2} + M{g^{2 + }} \to Mg{\left( {OH} \right)_2} + C{a^{2 + }}.\)
Phản ứng này xảy ra vì điều kiện trao đổi ion \(Ca{\left( {OH} \right)_2}\) tan trong \({H_2}O\) độ tan \({16.10^{ – 4}}\) mol/100g \({H_2}O\).
Bài 9: Cho \(10\) lít (đktc) hỗn hợp khí gồm \({N_2}\) và \(C{O_2}\) tác dụng với 2 lít dung dịch \(Ca{\left( {OH} \right)_2}\) nồng độ \(0,02\) mol/l thu được \(1\;g\) chất kết tủa.
Ta có: \({n_{Ca{{\left( {OH} \right)}_2}}} = 0,02.2 = 0,04mol > {n_{CaC{O_3}}} = {1 \over {100}} = 0,01mol.\)
Có 2 trường hợp.
Trường hợp 1: \(Ca{\left( {OH} \right)_2}\) dư ,\(C{O_2}\) thiếu.
\(\eqalign{
& Ca{\left( {OH} \right)_2} + C{O_2} \to CaC{O_3} + {H_2}O. \cr
& \cr} \)
\(0,01 \leftarrow 0,01\)
\( \Rightarrow \% {V_{C{O_2}}} = {{0,01.22,4} \over {10}} .100\%= 2,24\% \Rightarrow \% {V_{{N_2}}} = 97,76\% .\)
Trường hợp 2: \(Ca{\left( {OH} \right)_2}\) thiếu , \(CO_2\) dư.
\(Ca{\left( {OH} \right)_2} + C{O_2} \to CaC{O_3} + {H_2}O\)
\(0,04 \to 0,04 \to 0,04\)
\(CaC{O_3} + C{O_2}dư + {H_2}O \to Ca{\left( {HC{O_3}} \right)_2}\)
\((0,04 – 0,01) \to 0,03\)
\( \Rightarrow \% {V_{C{O_2}}} = {{\left( {0,04 + 0,03} \right).22,4} \over {10}}.100 = 15,68\% \Rightarrow \% {V_{{N_2}}} = 84,32\% .\)
Bài 10: Có 3 cốc đựng lần lượt: nước mưa, nước có tính cứng tạm thời, nước có tính cứng vĩnh cửu. Hãy nhận biết nước đựng trong mỗi cốc bằng phương pháp hóa học. Viết phương trình hóa học.
– Đun nóng cả 3 mẫu thử: Mẫu xuất hiện kết tủa là nước cứng tạm thời, hai mẫu còn lại nước mưa và nước vĩnh cửu.
\(Ca{\left( {HC{O_3}} \right)_2}\buildrel {{t^0}} \over
\longrightarrow CaC{O_3} \downarrow + C{O_2} \uparrow + {H_2}O\)
– Cho hai mẫu thử còn lại tác dụng với dung dịch \(N{a_2}C{O_3}\): Mẫu thử xuất hiện kết tủa là nước cứng vĩnh cửu. Mẫu còn lại là nước mưa.
\({Mg^{2 + }} + CO_3^{2 – } \to MgC{O_3} \downarrow \)
\({Ca^{2 + }} + CO_3^{2 – } \to CaC{O_3} \downarrow \)
Bài 11: Cần bao nhiêu gam \(N{a_2}C{O_3}\) vừa đủ để làm mềm một lượng nước cứng, biết lượng \(CaS{O_4}\) có trong lượng nước cứng trên là \({6.10^{ – 5}}\) mol.
\(\eqalign{
& N{a_2}C{O_3} + CaS{O_4} \to CaC{O_3} \downarrow + N{a_2}S{O_4} \cr
& {6.10^{ – 5}} \leftarrow {6.10^{ – 5}} \cr} \)
Vậy:
\({m_{N{a_2}C{O_3}}} = {6.10^{ – 5}}.106 = 6,{36.10^{ – 3}}\left( g \right)\)
Bài 12: Tính tổng khối lượng theo mg/lít của các ion \(C{a^{2 + }}\) và \(M{g^{2 + }}\) có trong một loại nước tự nhiên. Biết rằng trong nước này có chứa đồng thời các muối \(Ca{(HC{O_3})_2},{\rm{ }}Mg{(HC{O_3})_2}\) và \(CaS{O_4}\) với khối lượng tương ứng là \(112,5\) mg/l, \(11,9\) mg/l và \(54,5\) mg/l.

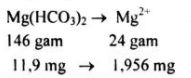

Tổng nồng độ (ml/g) của các ion \(C{a^{2 + }}\) và \(M{g^{2 + }}\):
\(27,778+1,956+16,03=45,764\) (mg/l)

