Bài 1 SGK: Trong pin điện hoá, sự oxi hoá
A. Chỉ xảy ra ở cực âm
B. Chỉ xảy ra ở cực dương
C. Xảy ra ở cực dương và cực âm
D. Không xảy ra ở cực dương và cực âm
Chọn A
Bài 2 SGK: Trong pin điện hoá \(Zn-Cu\) cặp chất nào sau đây phản ứng được với nhau?
\(\eqalign{
& A.Z{n^{2 + }} + C{u^{2 + }} \cr
& B.Z{n^{2 + }} + Cu \cr
& C.C{u^{2 + }} + Zn \cr
& D.Cu + Zn \cr} \)
Chọn C.
Bài 3 SGK: Cho các kim loại: \(Na, Mg, Al, Cu, Ag\). Hãy viết các cặp oxi hoá – khử tạo bởi các kim loại đó và sắp xếp chúng theo thứ tự giảm dần tính oxi hoá.
Giải : Các cặp oxi – hoá theo thứ tự giảm dần tính oxi hoá.
\({{A{g^ + }} \over {Ag}};{{C{u^{2 + }}} \over {Cu}};{{A{l^{3 + }}} \over {Al}};{{M{g^{2 + }}} \over {Mg}};{{Na + } \over {Na}}.\)
Bài 4 SGK: Có những pin điện hoá được cấu tạo bởi các cặp oxi hoá – khử sau:
a. \(P{b^{2 + }}/Pb\) và \(F{e^{2 + }}/Fe\)
b. \(A{g^ + }/Ag\) và \(F{e^{2 + }}/Fe\)
c. \(A{g^ + }/Ag\) và \(P{b^{2 + }}/Pb\)
hãy cho biết:
– Dấu và tên của các điện cực trong mỗi pin điện hoá.
– Những phản ứng xảy ra ở các điện cực và phản ứng oxi hoá – khử trong mỗi pin điện hoá.
Advertisements (Quảng cáo)
Dấu và tên của các điện cực trong pin điện hoá:
a. Anot (cực âm) \(Fe \to F{e^{2 + }} + 2e.\)
Catot (cực dương) \(P{b^{2 + }} + 2e \to Pb.\)
Phản ứng hoá học: \(Fe + P{b^{2 + }} \to F{e^{2 + }} + Pb.\)
b. Anot (cực âm) \(Fe \to F{e^{2 + }} + 2e.\)
Catot (cực dương) \(A{g^ + } + e \to Ag.\)
Phản ứng hoá học: \(Fe + 2A{g^ + } \to F{e^{2 + }}2Ag.\)
c. Anot (cực âm) \(P{b^{2 + }} + 2e \to Pb.\)
Catot (cực dương) \(A{g^ + } + e \to Ag.\)
Phản ứng hoá học: \(Pb + 2A{g^ + } \to P{b^{2 + }} + 2Ag.\)
Bài 5 SGK: Suất điện động chuẩn của pin điện hoá \(Sn – Ag\) là
A. \(0,66\,V\)
B. \(0,79\,V\)
Advertisements (Quảng cáo)
C. \(0,94\,V\)
D. \(1,09\,V\).
Chọn C.
\({\rm E}_{pin}^0 = {\rm E}_{A{g^ + }/Ag}^0 – {\rm E}_{S{n^{2 + }}/Sn}^0 = 0,8 – ( – 0,14) = 0,94V.\)
Bài 6 SGK
Hãy cho biết chiều của phản ứng hoá học xảy ra giữa các cặp oxi hoá – khử: \(A{g^ + }/Ag;A{l^{3 + }}/Al\) và \(2{H^ + }/{H_2}\). Giải thích và viết phương trình hoá học.
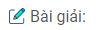
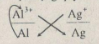 \(Al + 3A{g^ + } \to A{l^{3 + }} + 3Ag.\)
\(Al + 3A{g^ + } \to A{l^{3 + }} + 3Ag.\)
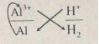 \(2Al + 6{H^ + } \to 2A{l^{3 + }} + 3{H_2}.\)
\(2Al + 6{H^ + } \to 2A{l^{3 + }} + 3{H_2}.\)
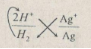 \(2A{g^ + } + {H_2} \to 2Ag + 2{H^ + }\)
\(2A{g^ + } + {H_2} \to 2Ag + 2{H^ + }\)
Bài 7 SGK: Biết phản ứng oxi hoá – khử xảy ra trong một pin điện hoá là:
\(Fe + N{i^{2 + }} \to F{e^{2 + }} + Ni\)
a. Hãy xác định các điện cực âm và dương của pin điện hoá.
b. Viết phương trình của phản ứng oxi hoá và phản ứng khử xảy ra trên mỗi điện cực.
c. Tính suất điện động chuẩn của pin điện hoá.
a. Cực âm Fe. Cực dương Ni.
b. Phương trình của phản ứng oxi hoá và phản ứng khử xảy ra trên mỗi điện cực.
Cực âm: \(Fe \to F{e^{2 + }} + 2e.\)
Cực dương: \(N{i^{2 + }} + 2e \to Ni.\)
Phương trình hoá học: \(Fe + N{i^{2 + }} \to F{e^{2 + }} + Ni.\)
c. Suất điện động chuẩn của pin điện hoá: \({\rm E}_{Pin}^0 = {\rm E}_{N{i^{2 + }}/Ni}^0 – {\rm E}_{F{e^{2 + }}/Fe}^0 = – 0,26 – \left( { – 0,44} \right) = 0,18(V).\)
Bài 8 SGK: Tính thế điên cực chuẩn \({{\rm E}^0}\) của những cặp oxi hoá-khử sau:
\(\eqalign{
& a.{\rm E}_{C{r^{3 + }}/Cr}^0 \cr
& b.{\rm E}_{M{n^{2 + }}/Mn}^0 \cr} \)
Biết:
-Suất điện động chuẩn của các pin điện hoá:
\(Cr-Ni\) là \(+0.48\,V\) và của pin \(Cd-Mn\) là \(+0,79\,V\)
– Thế điện cực chuẩn \({\rm E}_{C{d^{2 + }}/Cd}^0 = – 0,40V\) và \({\rm E}_{N{i^{2 + }}/Ni}^0 = – 0,26V\)
a. Ta có:
\(\eqalign{
& {\rm E}_{Pin(Cr – Ni)}^0 = {\rm E}_{N{i^{2 + }}/Ni}^0 – {\rm E}_{C{r^{3 + }}/Cr}^0 \cr
& \Rightarrow {\rm E}_{C{r^{3 + }}/Cr}^0 = {\rm E}_{N{i^{2 + }}/Ni}^0 – {\rm E}_{Pin(Cr – Ni)}^0 = – 0,77V \cr} \)
b. Ta có:
\(\eqalign{
& {\rm E}_{Pin\left( {Mn – Cd} \right)}^0 = {\rm E}_{C{d^{2 + }}/Cd}^0 – {\rm E}_{M{n^{2 + }}/Mn}^0 \cr
& \Rightarrow {\rm E}_{M{n^{2 + }}/Mn}^0 = {\rm E}_{C{d^{2 + }}/Cd}^0 – {\rm E}_{Pin\left( {Mn – Cd} \right)}^0 = – 1,19V. \cr} \)

