Bài 15.1: a) Viết công thức về khối lượng cho phản ứng giữa kim loại kẽm và axit clohiđric HCl tạo ra chất kẽm clorua ZnCl2 và khí hiđro. (Xem lại hình 2.6, trong SGK về phản ứng này).
b) Cho biết khối lượng của kẽm và axit clohiđric đã phản ứng là 6,5 g và 7,3 g, khối lượng của chất kẽm clorua là 13,6 g.
Hãy tính khối lượng của khí hiđro bay lên.
Giải
a) \({m_{Zn}} + {m_{HCl}} = {m_{ZnC{l_2}}} + {m_{{H_2}}}\)
b) \({m_{{H_2}}} = 6,5 + 7,3 – 13,6 = 0,2(g)\)
Bài 15.2: Biết rằng axit clohiđric có phản ứng với chất canxi cacbonat tạo ra chất canxi clorua, nước và khí cacbon đioxit.
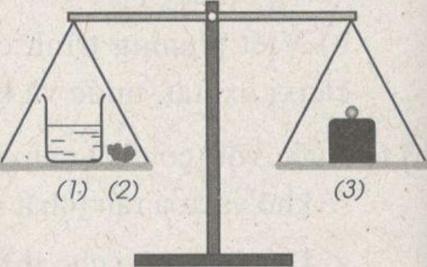
Một cốc đựng dung dịch axit clohiđric (1) và cục đá vôi (2) (thành phần chính là chất canxi cacbonat) được đặt trên một đĩa cân. Trên đĩa cân thứ hai đặt quả cân (3) vừa đủ cho cân ở vị trí thăng bằng.
Advertisements (Quảng cáo)
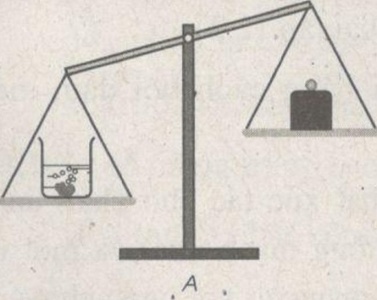
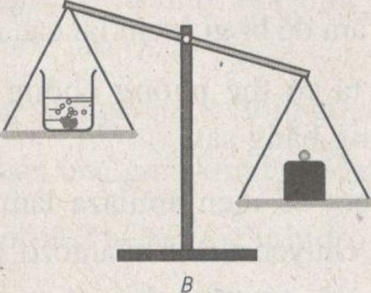
Bỏ cục đá vôi vào dung dịch axit clohiđricẽ Sau một thời gian phản ứng, cân sẽ ở vị trí nào : A, B hay C ? Giải thích.
Giải
Sau một thời gian phản ứng, cân sẽ ở vị trí B. Vì trong phản ứng có một lượng khí cacbon đioxit thoát ra làm cho khối lượng hụt đi.
Bài 15.3: Hãy giải thích vì sao :
Advertisements (Quảng cáo)
a)Khi nung nóng cục đá vôi thì thấy khối lượng giảm đi. (Xem lại bài tập 12.3 về đá vôi trong lò nung vôi).
b)Khi nung nóng miếng đồng trong không khí (có khí oxi) thì thấy khối lượng tăng lên. (Xem bài tập 3, thuộc bài 15, SGK ; khi đun nóng kim loại đồng (Cu) cũng có phản ứng tương tự kim loại magie (Mg)).
Giải
(Xem lại tập 12.3.) a) Khi nung nóng cục đá vôi thì chất canxi cacbonat bị phân huỷ thành chất canxi oxit và khí cacbon đioxit thoát ra nên khối lượng giảm đi.
b) Khi nung nóng miếng đồng trong không khí thì đồng hoá hợp với khí oxi tạo ra một chất mới nên khối lượng tăng lên.
Bài 15.4: Đun nóng mạnh hỗn hợp gồm 28 g bột sắt và 20 g bột lưu huỳnh thu được 44 g chất sắt(II) sunfua (FeS) màu xám.
Biết rằng, để cho phản ứng hoá hợp xảy ra hết người ta đã lấy dư lưu huỳnh. Tính khối lượng lưu huỳnh lấy dư.
Giải
Công thức khối lượng của phản ứng :
mFe + mS = mFeS Khối lượng lưu huỳnh đã hoá hợp với sắt bằng :
mS = mFeS – mFe = 44 – 28 = 16 (g)
Phần khối lượng lưu huỳnh lấy dư bằng :
20- 16 = 4 (g)

