Bài 26.9: Cho 5,6 gam bột sắt vào bình khí clo có dư. Sau phản ứng thu được 16,25 gam muối sắt. Tính khối lượng khí clo đã tham gia phản ứng.

Phương trình hoá học : 2Fe + 3Cl2 \(\buildrel {{t^o}} \over\longrightarrow \) 2FeCl3
Theo định luật bảo toàn khối lượng :
\({m_{Fe}} + {m_{C{l_2}}} = {m_{FeC{l_3}}}\)
\({m_{C{l_2}}} = {m_{FeC{l_3}}} – {m_{Fe}} = 16,25 – 5,6 = 10,65(gam)\)
Bài 26.10: Cho 12,7 gam muối sắt clorua vào dung dịch NaOH có dư trong bình kín, thu được 9 gam một chất kết tủa. Công thức hoá học của muối là
A. FeCl3 ; B. FeCl2 ; C. FeCl; D. FeCl4

Đáp án B.
Gọi công thức của muối là \(FeC{l_x}\) (x là hóa trị của kim loại Fe).
Phương trình hóa học:
Advertisements (Quảng cáo)
\(FeC{l_x}\,\,\,\,\,\,\,\,\,\,\, + \,\,\,\,\,xNaOH \to Fe{(OH)_x}\,\,\,\, + \,\,\,\,\,\,xNaCl\)
(56+35,5x)gam (56+17x)gam
12,7 gam 9 gam
Ta có tỷ lệ: \({{56 + 35,5x} \over {12,7}} = {{56 + 17x} \over 9} \Rightarrow x = 2 \to \) công thức của muối là \(FeC{l_2}\)
Bài 26.11: Viết các phương trình hoá học của các phản ứng sau (ghi rõ điều kiện phản ứng, nếu có)
\(C{l_2} + A \to B\)
\(B + Fe \to C + {H_2} \uparrow \)
Advertisements (Quảng cáo)
\(C + E \to F \downarrow + NaCl\)
\(F + B \to C + {H_2}O\)

\(C{l_2} + {H_2}\buildrel {{t^o}} \over\longrightarrow 2HCl\)
A B
\(2HCl + Fe \to FeC{l_2} + {H_2} \uparrow \)
B C
\(FeC{l_2} + 2NaOH \to Fe{(OH)_2} \downarrow + 2NaCl\)
C E F
\(Fe{(OH)_2} + 2HCl \to FeC{l_2} + 2{H_2}O\)
F B C
Bài 26.12: Qua hình vẽ 3.2, em hãy cho biết mức độ phản ứng giữa clo và hiđro.
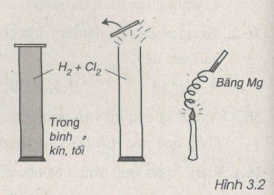

Qua hình vẽ ta nhận thấy khi có ánh sáng (băng Mg cháy), Cl2 phản ứng rất mạnh với H2 nên nắp bình bị bật ra.

