Bài 5.52: Có hai nguyên tố halogen khi ở dạng đơn chất đều độc hại với cơ thể người, nhưng ở dạng hợp chất muối natri lại cần thiết đối với cơ thể người. Hãy cho biết tên 2 nguyên tố đó và tên hợp chất muối natri của chúng.
– Hai nguyên tố đó là clo và iot.
– Hợp chất của chúng là natri clorua (NaCl) và natri iotua (NaI).
Bài 5.53: Vì sao trong các hợp chất, Flo luôn có số oxi hoá âm còn các halogen khác, ngoài số oxi hoá âm còn có số oxi hoá dương ?
Vì Flo là phi kim mạnh nhất trong số tất cả các phi kim nên trong các phản ứng nó chỉ thu thêm e nên luôn luôn có số oxi hoá âm.Các halogen khác còn có số oxi hoá dương vì còn có những phi kim mạnh hơn chúng nên chúng có thể nhường e cho phi kim này.
Bài 5.54: Cho một luồng khí \(Cl_2\) qua dung dịch KBr một thời gian dài. Có thể có những phản ứng hoá học nào xảy ra ? Viết PTHH của các phản ứng đó.
Có các phản ứng sau :
Clo đẩy brom ra khỏi muối KBr :
\(Cl_2 + 2KBr → 2KC1 + Br_2\) (1)
Một phần clo tác dụng với nước :
Advertisements (Quảng cáo)
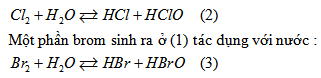
Một phần clo đẩy brom ra khỏi HBr :
\(Cl_2 + 2HBr → 2HCl + Br_2\) (4)
Dưới tác dụng của ánh sáng, các axit HCIO và HBrO bị phân huỷ :
\(2HClO →2HCl + O_2\) . (5)
\(2HBrO→ 2HBr + O_2\) (6)
Bài 5.55: Nêu phương pháp hoá học để phân biệt các dung dịch NaCl, NaBr, NaI. Viết PTHH của các phản ứng.
Advertisements (Quảng cáo)
Sục khí \(Cl_2\) vào các dung dịch trên đã được cho thêm hồ tinh bột.
– Dung dịch nào không có hiện tượng gì xảy ra, đó là dung dịch NaCl.
– Dung dịch nào có chất lỏng màu nâu tạo thành, đó là dung dịch NaBr :
\(Cl_2 + 2NaBr → 2NaCl + Br_2\)
– Dung dịch nào có màu xanh xuất hiện, đó là dung dịch NaI:
\(Cl_2 + 2NaI → 2NaCl + I_2\)
(\(I_2\) gặp hồ tinh bột tạo ra hợp chất có màu xanh).
Bài 5.56: Trình bày phương pháp công nghiệp sản xuất flo, brom, iot.
– Sản xuất flo : Trong công nghiệp, flo được sản xuất bằng cách điện phân KF tan trong HF lỏng. khan.
Sản xuất brom : Trong công nghiệp, người ta dùng \(Cl_2\) để oxi hoá NaBr có trong nước biển thành \(Br_2\).
Sản xuất iot : Trong công nghiệp, người ta sản xuất \(I_2\) từ rong biển
Bài 5.57: Cho 19,05 gam hỗn hợp KF và KCl tác dụng hết với dung dịch H2SO4 đặc thu được 6,72 lít khí (đktc). Xác định thành phần % theo khối lượng của hỗn hợp muối.
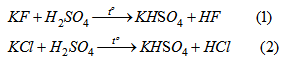 \(n_{khí}\)= \({{6,72} \over {22,4}} = 0,3\left( {mol} \right)\)
\(n_{khí}\)= \({{6,72} \over {22,4}} = 0,3\left( {mol} \right)\)
Gọi x , y lần lượt là số mol KF và KCl, ta có :
\(\left\{ \begin{array}{l}
58{\rm{x}} + 74,5y = 19,05\\
x + y = 0,3
\end{array} \right.\)
Giải hệ ta được x =0,2 , y= 0,1.
\(\begin{array}{l}
{m_{KF}} = 58.0,2 = 11,6 \Rightarrow \% {m_{KF}} = \frac{{11,6}}{{19,05}}.100\% = 60,89\% \\
\% {m_{KCl}} = 100\% – 60,89\% = 39,11\%
\end{array}\)

