Bài 4.44: Cho 2,24 gam sắt tác dụng với dung dịch HCl dư. Khí sinh ra cho đi qua ống đựng 4,2 gam CuO được đốt nóng. Xác định khối lượng của chất rắn ở trong ống sau phản ứng.
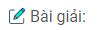
\(Fe + 2HCl \to FeC{l_2} + {H_2}\,\,\,\,\,\,\,\,\,\,\,\,\,(1)\)
Theo PTHH (1) ta có
\(\begin{array}{l}
{n_{{H_2}}} = {n_{Fe}}{\rm{ }} = \frac{{2,24}}{{56}} = {\rm{ }}0,04{\rm{ }}\left( {mol} \right).\\
CuO + {H_2} \to Cu + {H_2}O\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,(2)
\end{array}\)
Theo PTHH (2) :
Số mol CuO phản ứng : n_{CuO} = n_{H_2} = 0,O_4 mol.
Số mol Cu tạo ra là 0,O_4 mol.
Số mol CuO dư \({{4,2} \over {80}} – 0,O_4 = 0,0125\,(mol)\)
Sau phản ứng trong ống nghiệm có: \(m_{Cu}=64×0,O_4=2,56 (g)\)
\(m_{CuO}=80×0,0125=1 (g)\).
Khối lượng chất rắn : 1+ 2,56=3,56 (g).
Bài 4.45: Nguyên tố nitơ trong các hợp chất có số oxi hoá thấp nhất là -3 và cao nhất là +5. Xác định số oxi hoá của nitơ trong các hợp chất sau và xét xem trong hợp chất nào nitơ chỉ có tính oxi hoá, trong hợp chất nào nitơ chỉ có tính khử ?
Advertisements (Quảng cáo)
a)\(NH_3, N_2O, HNO_3, NO_2\).
b)\(NH_4Cl, NO, HNO_2, N_2O_5\)
\(a)\mathop {\,\,\,\,N}\limits^{ – 3} {H_3}\,\,\,\,\,\,\,\,\,\,\,\,{\mathop N\limits^{ + 1} _2}O\,\,\,\,\,\,\,\,\,\,\,\,\mathop N\limits^{ + 4} {O_2}\,\,\,\,\,\,\,\,\,\,\,\,H\mathop N\limits^{ + 5} {O_3}\)
N chỉ có tính khử N chỉ có tính oxi hóa
\(b)\,\,\mathop N\limits^{ – 3} {H_4}Cl\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\mathop N\limits^{ + 2} O\,\,\,\,\,\,\,\,\,\,\,\,\,\,H\mathop N\limits^{ + 3} {O_2}\,\,\,\,\,\,\,\,\,\,\,\,\,\,{\mathop N\limits^{ + 5} _2}{O_5}\)
chỉ có tính khử N chỉ có tính oxi hóa
Advertisements (Quảng cáo)
Bài 4.46: Nhúng thanh kẽm vào 100 ml dung dịch \(AgNO_3\) 0,1M. Tính khối lượng bạc kim loại được giải phóng và khối lượng kẽm đã chuyển vào dung dịch.
\(n_{AgNO_3}=0,1×0,1=0,01\) (mol)
\(\begin{array}{l}
Zn\,\,\,\,\,\,\,\,\,\,\,\, + \,\,\,\,\,\,\,\,\,\,\,\,\,2AgN{O_3} \to Zn{(N{O_3})_2} + 2{\rm{A}}g \downarrow \\
0,005\,\,mol\, \leftarrow \,\,\,\,0,01\,mol \to \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,01\,mol\\
{m_{Ag}} = 108.0,01 = 1,08\left( g \right)\\
{m_{Zn}} = 65.0,005 = 0,325\left( g \right)
\end{array}\)
Bài 4.47: Cho 2,6 gam bột kẽm vào 100 ml dung dịch \(CuCl_2\) 0,75M. Lắc kĩ cho đến khi phản ứng kết thúc. Xác định số mol của các chất trong dung dịch thu được.
\(\begin{array}{l}
{n_{Zn}} = \frac{{2,6}}{{65}} = 0,04\left( {mol} \right)\\
{n_{CuC{l_2}}} = 0,1.0,75 = 0,075\left( {mol} \right)\\
Zn\,\,\,\,\,\,\,\, + \,\,\,\,\,\,\,\,\,\,\,CuC{l_2} \to ZnC{l_2}\,\,\, + \,\,\,\,\,\,Cu\\
0,04\,mol\,\, \to \,\,0,04\,mol \to 0,04\,mol
\end{array}\)
Trong dung dịch thu được ta có:
\(\begin{array}{l}
{n_{ZnC{l_2}}} = 0,04\,mol\\
{n_{CuC{l_2}}} = 0,075 – 0,04 = 0,035\,mol
\end{array}\)
Bài 4.48: Hỗn hợp khí A gồm clo và oxi. A phản ứng vừa hết với hỗn hợp gồm 4,8 gam magie và 8,1 gam nhôm tạo ra 37,05 gam hỗn hợp các muối clorua và oxit của 2 kim loại. Tính số mol clo và oxi trong A.
Gọi số mol \(Cl_2\) và \(O_2\) lần lượt là x và y, ta có hệ phương trình:
2x+4y=0,4+0,9 ( ĐL bảo toàn e) x=0,25
71x+32y=24,5 ( ĐL bảo toàn khối lượng) y=0,2
Bài 4.49: Một dung dịch X có chứa 46,5 gam hỗn hợp \(NaCl, MgCl_2, ZnCl_2\) phản ứng vừa đủ với dung dịch \(AgNO_3\), thu được 114,8 gam kết tủa và dung dịch Y. Tính khối lượng muối trong dung dịch Y.
\(Ag^+ + Cl^- \) →AgCl →\(n_{AgNO_3}=0,8 mol\). Áp dụng ĐL BTKL:
0,8 ← 0,8 \(m_X +m_{ AgNO_3}=m_{kết\, tủa}+m_{muối\, Y}\)
\(m_{muối\, Y}=46,5+0,8.170-114,8=67,7 (gam)\)

