Bài 9.9: Viết các phương trình hoá học của quá trình điều chế anđehit axetic xuất phát từ mỗi hiđrocacbon sau đây :
1. Axetilen ;
2. Etilen ;
3. Etan ;
4. Metan.
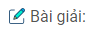
1.  + \({H_2}O\)
+ \({H_2}O\) 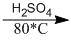
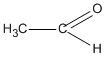
2. \(2C{H_2} = C{H_2} + {O_2}\)  \(2C{H_3} – CHO\)
\(2C{H_3} – CHO\)
3. \(C{H_3} – C{H_3}\) 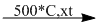 \(C{H_2} = C{H_2} + {H_2}\)
\(C{H_2} = C{H_2} + {H_2}\)
Sau đó có phản ứng 2.
4. \(2C{H_4}\) 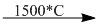
 + \(3{H_2}\)
+ \(3{H_2}\)
Sau đó có phản ứng 1.
Bài 9.10: Chất A là một anđehit đơn chức. Cho 10,50 g A tham gia hết vào phản ứng tráng bạc. Lượng bạc tạo thành được hoà tan hết vào axit nitric loãng làm thoát ra 3,85 lít khí NO (đo ở 27,3°C và 0,8 atm).
Xác định công thức phân tử, công thức cấu tạo và tên chất A.
Đổi thể tích khí NO về đktc :
\({V_o} = \frac{{pV}}{T}.\frac{{{T_o}}}{{{p_o}}} = \frac{{0,8.3,85}}{{300,3}}.\frac{{273}}{1} = 2,8(l)\)
R – CHO + 2AgN03 + 3NH3 + H20 \( \to \) RCOONH4 + 2NH4N03 + 2Ag
Advertisements (Quảng cáo)
3Ag + 4HN03 \( \to \) 3AgN03 + NO + 2H20
Số mol Ag = 3.số mol NO = 3.\(\frac{{2,8}}{{22,4}}\) = \({{{3,75.10}^{ – 1}}}\) (mol).
Số mol RCHO = \(\frac{1}{2}\)Số mol Ag = \(\frac{{{{3,75.10}^{ – 1}}}}{2}\) .
Khối lượng của 1 mol RCHO = \(\frac{{10,5.2}}{{{{3,75.10}^{ – 1}}}}\) = 56 (g).
RCHO = 56 \( \Rightarrow \) R = 56 – 29 = 27 \( \Rightarrow \) R là -C2H3
CTPT là \({C_3}{H_4}O\).
CTCT là CH2 = CH – CHO (propenal).
Bài 9.11: Để đốt cháy hoàn toàn một lượng chất hữu cơ A phải dùng vừa hết 3,08 lít \({O_2}\).Sản phẩm thu được chỉ gồm có 1,80 g H20 và 2,24 lít C02. Các thể tích khí đo ở đktc.
1. Xác định công thức đơn giản nhất của A.
2. Xác định công thức phân tử của A, biết rằng tỉ khối hơi của A đối với oxi là 2,25.
3. Xác định công thức cấu tạo có thể có của chất A, ghi tên tương ứng, biết rằng A là hợp chất cacbonyl.
Advertisements (Quảng cáo)
1. Theo định luật bảo toàn khối lượng :
\({m_A} = {m_{C{O_2}}} + {m_{{H_2}O}} – {m_{{O_2}}} = \frac{{2,24}}{{22,4}}.44 + 1,8 – \frac{{3,08}}{{22,4}}.32\) = 1,8 (g)
Khối lượng C trong 1,8 g A là : \(\frac{{12.2,24}}{{22,4}}\) = 1,2 (g).
Khối lượng H trong 1,8 g A là : \(\frac{{2.1,8}}{{18}}\) = 0,2 (g).
Khối lượng O trong 1,8 g A là : 1,8 – 1,2 – 0,2 = 0,4 (g).
Công thức chất A có dạng CxHyOz :
x : y : z = \(\frac{{1,2}}{{12}}:\frac{{0,2}}{1}:\frac{{0,4}}{{16}}\) = 0,1 : 0,2 : 0,025 = 4:8:1
CTĐGN là C4H8O
2. MA = 2,25.32 = 72 (g/mol)
\( \Rightarrow \) CTPT trùng với CTĐGN : C4H8O.
3. Các hợp chất cacbonyl C4H8O :
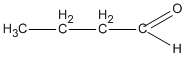 (butanal )
(butanal )
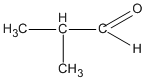 ( 2-metylpropanal )
( 2-metylpropanal )
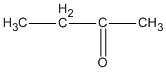 ( butan-2-ol )
( butan-2-ol )
Bài tập 9.12: Hỗn hợp M chứa ba chất hữu cơ A, B và C là 3 đồng phân của nhau. A là anđehit đơn chức, B là xeton và C là ancol. Đốt cháy hoàn toàn 1,45 g hỗn hợp M, thu được 1,68 lít khí C02 (đktc) và 1,35 g \({H_2}O\).
Hãy xác định công thức phân tử, công thức cấu tạo và tên của A, B và C.
Ba chất A, B, C là đồng phân nên có CTPT giống nhau. A là anđehit đơn chức nên phân tử A chỉ có 1 nguyên tử oxi. Vậy A, B và C có công thức phân tử CxHyO. Khi đốt cháy hoàn toàn hỗn hợp M :
\({C_x}{H_y}O + (x + \frac{y}{4} – \frac{1}{2}){O_2} \to xC{O_2} + \frac{y}{2}{H_2}O\)
Theo phương trình : (12x + y + 16) g M tạo ra x mol C02 và \(\frac{y}{2}\) mol \({H_2}O\)
Theo đầu bài : 1,45 g M tạo ra \(\frac{1,68}{22,4}\) mol C02 và \(\frac{1,35}{18}\) mol \({H_2}O\)
\(\frac{{12{\rm{x}} + y + 16}}{{1,45}} = \frac{x}{{0,075}} = \frac{y}{{0,15}}\)
\( \Rightarrow \) x = 3 ; y = 6.
CTPT của A, B và C là C3H60.
A là 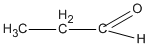 (propanal) ;
(propanal) ;
B là 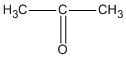 (propanon hay axeton) ;
(propanon hay axeton) ;
C là CH2 = CH – CH2 – OH (propenol).

