Bài 7.114: Dung dịch A có chứa CuSO4 và Fe2(SO4)3
a) Thêm Mg vào dung dịch A→ dung dịch B có 3 muối tan.
b) Thêm Mg vào dung dịch A → dung dịch C có 2 muối tan.
Viết PTHH của các phản ứng xảy ra.
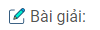
a) Mg +Fe2(SO4)3 → MgSO4 + 2FeSO4 (1)
Mg + CuSO4→ MgS04 + Cu (2)
Dung dịch B có 3 muối là MgSO4, FeSO4 và CuSO4 dư.
b) Dung dịch C có 2 muối tan là MgSO4 và FeSO4.
Bài 7.115: Nhận biết từng oxit kim loại riêng biệt sau bằng phương pháp hoá học : CuO, Al2O3, FeO, Fe3O4, Fe2O3, CaO. Giải thích và viết phương trình hoá học của các phản ứng
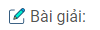
Dùng H2O nhận biết CaO.
Dùng dung dịch HCl hoà tan các oxit được dung dịch muối clorua. Dung dịch nào có màu xanh thì oxit ban đầu là CuO. Dung dịch nào không màu tác dụng với NaOH tạo kết tủa keo tan trong NaOH dư thì oxit ban đầu là A12O3. Dung dịch màu lục nhạt tác dụng với NaOH tạo kết tủa trắng xanh chuyển dần-sang màu nâu đỏ thì oxit ban đầu là FeO.
Nhận biết Fe2O3 và Fe3O4 bằng dung dịch HNO3 loãng, phản ứng không giải phóng khí là Fe2O3, giải phóng khí hoá nâu trong không khí là Fe3O4.
3Fe3O4 + 28HNO3 → 9Fe(NO3)3 + NO↑+ 14H2O.
Bài 7.116: Muốn có đủ khí clo để tác dụng với 1,12 g Fe cần phải dùng bao nhiêu gam K2Cr2O7 và bao nhiêu mililít dung dịch HCl 36,5% (D = 1,19 g/ml)
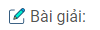
n Fe= 1,12: 56= 0,04 mol
Các phản ứng xảy ra:
K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2 + 7H2O (1)
2Fe + 3Cl2 → 2FeCl3 (2)
Theo pt (2) ta có : \({n_{C{l_2}}} = {3 \over 2}{n_{Fe}} = 0,03mol\)
Theo pt (1) ta có :
Advertisements (Quảng cáo)
\(\eqalign{
& {n_{HCl}} = {{14} \over 3}{n_{C{l_2}}} = {{14} \over 3}.0,03 = 0.14mol \cr
& \to {m_{{\rm{dd}}HCl}} = {{0,14.36,5.100} \over {36,5}} = 14g \cr
& \to {V_{HCl}} = {{{m_{{\rm{dd}}HCl}}} \over d} = {{14} \over {1,19}} = 11,76ml \cr
& {n_{{K_2}C{r_2}{O_7}}} = {{{n_{C{l_2}}}} \over 3} = 0,01mol \cr
& \to {m_{{K_2}C{r_2}{O_7}}} = 0,01.294 = 2,94g \cr} \).
Bài 7.117: Hỗn hợp A gồm Fe và kim loại M có hoá trị không đổi trong mọi hợp chất, M đứng trước hiđro trong dãy điện hoá. Tỉ lệ số mol của M và Fe trong hỗn hợp A là 1 : 2. Cho 13,9 g hỗn hợp A tác dụng với khí Cl2 thì cần dùng 10,08 lít Cl2. Cho 13,9 g hỗn hợp A tác dụng với dung dịch HCl thì thu được 7,84 lít H2. Các thể tích khí đều đo ở đktc. Xác định kim loại M và % khối lượng của mỗi kim loại trong hỗn hợp A.
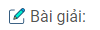
2M + 2nHCl → MCln + n H2
x 0,5nx(mol)
Fe + 2HCl → FeCl2 + H2
2x 2x (mol)
\(0,5nx + 2x = {{7,84} \over {22,4}} = 0,35\) (1)
2M + nCl2 → 2MCln
x 0,5nx(mol)
2Fe + 3Cl2 → 2FeCl3
2x 3x (mol)
\(0,5nx + 3x = {{10,08} \over {22,4}} = 0,45(2)\)
Từ (1) và (2) → n= 3, x= 0,1
Advertisements (Quảng cáo)
mFe= 2.0,1.56= 11,2 g ; m M= 13,9-11,2= 2,7g
→M M= 2,7:0,1=27 → M là Al
\(\eqalign{
& \to \% {m_{Al}} = {{2,7} \over {13,9}}.100 = 19,42\% \cr
& \% {m_{Fe}} = 80,58\% \cr} \)
Bài 7.118: Cho luồng khí co dư đi qua ống sứ đựng m gam hỗn hợp FeO và Fe2O3 nung nóng. Sau khi kết thúc phản ứng, khối lượng chất rắn trong ống sứ là 5,5 gam. Cho khí đi ra khỏi ống sứ hấp thụ vào nước vôi trong dư thấy có 5 gam kết tủa. Xác định giá trị của m.
Ta có sơ đồ phản ứng :
\(CO + \left| \matrix{
FeO \hfill \cr
F{e_2}{O_3} \hfill \cr} \right.\buildrel {{t^0}} \over
\longrightarrow Fe + C{O_2}\)
Nhận thấy, cứ 1 mol CO phản ứng sinh ra 1 mol CO2 thì khối lượng chất rắn giảm 16 gam
Mặt khác ta có : n CO2 =nCaCO3 =0,05 mol ⟹ khối lượng rắn giảm = 0,05.16 = 0,8 (gam)
⟹ khối lượng hỗn hợp oxit sắt ban đầu là : m = 5,5 + 0,8 = 6,3 (gam).
Bài 7.119: Cho 18,5 gam hỗn hợp X gồm Fe, Fe304 tác dụng với 200 ml dung dịch HNO3 loãng đun nóng và khuấy đều. Sau khi phản ứng xảy ra hoàn toàn được 2,24 lít khí NO duy nhất (đktc), dung dịch Y và còn lại 1,46 gam kim loại. Xác định khối lượng muối trong Y và nồng độ mol của dung dịch HNO3.
Sau phản ứng kim loại còn dư, vậy Fe chỉ bị oxi hoá lên Fe2+
Gọi x, y là số mol Fe và Fe3O4 phản ứng, khối lượng rắn phản ứng là
18,5- 1,46= 17,04 (gam).
⟹ 56x + 232y = 17,04 gam (1)
Ta có phương trình cho – nhận e :
Fe → Fe2+ + 2e Fe304 + 2e → 3Fe +2
x → x → 2x mol y → 2y → 3y (mol)
N+5+ 3e → N+2
0,3 ← 0,1 (mol)
Áp dụng ĐLBTĐT, ta có : 2x = 2y + 0,3 (2)
Từ (1) và (2), giải hệ ta có : x = 0,18; y = 0,03
Vậy muối thu được là Fe(NO3)2 : (x + 3y) = 0,27 mol ⟹ m = 48,6 g
Số mol HNO3 phản ứng = 2.nFe(NO3 )2 +nN0 = 2.0,27 + 0,1 = 0,64 mol
⟹ CM(HNO3) = 3,2 (M).
Bài 7.120: Hoà tan hoàn toàn 10 gam hỗn hợp X (Fe, Fe2O3) trong dung dịch HNO3 vừa đủ được 1,12 lít NO (đktc, sản phẩm khử duy nhất) và dung dịch Y. Cho Y tác dụng với NaOH dư được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi được m gam chất rắn. Xác định giá trị của m.
Ta có sơ đồ phản ứng:
\(10g\left| \matrix{
FeO \hfill \cr
F{e_2}{O_3} \hfill \cr} \right.\buildrel { + HN{O_3}} \over
\longrightarrow \left\{ \matrix{
NO:0,05mol \hfill \cr
F{e^{3 + }}\buildrel { + NaOH} \over
\longrightarrow Fe{(OH)_3}\buildrel {{t^0}} \over
\longrightarrow m\,gam\,F{e_2}{O_3} \hfill \cr} \right.\)
Vì chỉ có Fe phản ứng sinh ra khí NO, sử dụng phương trình cho – nhận e
⟹ nFe =nNO =0,05-mol.
m Fe ban đầu =0,05.56 = 2,8(gam) ⟹ m Fe2O3 sau = 160.0,025 = 4(gam)
\({m_{F{e_2}{O_3}}}\) ban đầu = 10 – 2,8 = 7,2 (gam)
Vậy m = 4 + 7,2 =11,2 (gam).

